
题目列表(包括答案和解析)
20.常温时,将VlmLC1mol·L-1的氨水滴加到V2mLC2mol·L-1的盐酸中,下述结论中正确的是
A.若混合溶液的pH=7,则C1V1>C2V2
B.若Vl=V2,C1=C2则混合液中c(NH4+)=c(Cl-)
C.若混合液的pH=7,则混合液中c(NH4+)>c(Cl-)
D.若V1=V2,且混合液的pH<7,则-定有C1<C2
第Ⅱ卷(非选择题,共60分)
19.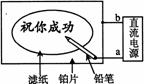 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A.铅笔端有少量的氯气产生 B.a点是正极,b点是负极
C.铂片端作阳极,发生氧化反应 D.铅笔端作阳极,发生还原反应
18.在密闭容器中反应:aX(g)+bY(g)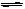 cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
A.a+b>c+d B.平衡向逆反应方向移动
C.Z的体积分数减小 D.X的转化率下降
17.将等物质的量的CH3COOH和CH3COONa溶于水中,测得c(CH3COO-) >c(Na+),则下列关系式正确的是
A.c(H+)<c(OH-) B.c(H+)>c(OH-)
C.c(OH-) > c(CH3COO-) D.c(CH3COO-) <c(CH3COOH)
16.镍镉充电电池,电极材料是Cd和NiO(OH),电解质是KOH,电极反应分别是:
Cd+2OH--2e-=Cd(OH)2 ;2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-。下列说法不正确的是
A.电池充电时,镉元素被还原
B.电池充电时,电池的正极和电源的正极相连接
C.电池放电时,负极周围溶液的pH不断增大
D.电池的总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2
15.在水电离出的c(H+)=1×10-12mol/L的溶液中,一定能大量共存的离子组是
A.Al3+、NH4+、SO42-、Cl- B.Na+、K+、CO32-、SO42-
C.K+、 Fe2+、Cl- 、NO3- D.Na+、Ba2+、Cl- 、NO3-
14.用标准的盐酸滴定未知浓度的NaOH溶液,下列各操作中,不会引起实验误差的
A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定
C.用移液管取10.00 mL的NaOH溶液,放入锥形瓶后,用水洗涤移液管,并将洗涤液也倒入锥形瓶中
D.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定
13.用锌和1mol/L稀硫酸溶液制取氢气,欲提高制取氢气的速率,下列措施不可行的是
A.使用更小颗粒的锌粒 B.改用98%的浓硫酸
C.滴入少量CuSO4溶液 D.加热
12.下列各组热化学方程式程中,△H的绝对值前者大于后者的是 ①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2 ②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4 ③H2(g)+1/2O2(g)=H2O(g);△H5 2H2(g)+O2(g)=2H2O(l);△H6
A.① B.② C.② ③ D.①②③
11.下列说法不正确的是
①在热化学方程式中无论是反应物还是生成物必须标明聚集状态;②所有的化学反应都伴随着能量变化;③放热的反应发生时不必加热;④吸热反应在加热后才能发生;⑤化学反应的热效应数值与参加反应的物质的多少有关;⑥一般来说,吸热反应在一定条件下也能发生;⑦依据盖斯定律,反应热的大小与反应的途径有关,无论是一步完成还是分几步完成,其反应热基本相同。
A.②③⑥⑦ B.③④⑤⑦ C.④⑤⑦ D.③④⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com