
题目列表(包括答案和解析)
2.据央视报道,自2005年12月1日起在武汉九市进行车用乙醇汽油封闭推广行动。车用乙醇汽油是把变性燃料乙醇和汽油按一定比例混配形成的一种新型汽车燃料。经多项检测结果表明,它不影响汽车的行驶性能,还可以减少有害气体的排放量。在美国、巴西等国早已推广使用。下列有关乙醇汽油的说法正确的是 ( )
A.乙醇汽油是一种纯净物
B.乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染
C.乙醇和汽油都可作溶剂,也可相互溶解
D.乙醇和乙二醇互为同系物
1.许多环境问题是跨国界的,甚至是全球性的。根据《蒙特利尔议定书》的有关要求,我
国政府采取了一系列措施来保护地球环境,如2002年起我国汽车业就全面禁用氟里昂(Freon)空调、2005年开始停止生产“哈龙(Halons)1211灭火器”等。这主要是由于氟 里昂、哈龙等物质都是 ( )
A.有机化合物 B.极易挥发的物质
C.破坏臭氧层的物质 D.是有毒的物质
28.(6分)25℃时,用物质的量浓度为0.04mol/L的氢氧化钠溶液去中和H+浓度为10-3mol/L的某一元弱酸溶液20mL,消耗氢氧化钠溶液12.5mL,试求:
(1)一元弱酸物质的量浓度?
(2)一元弱酸的电离度?
27.(6分)向50mL 0.018 mol/L的Ag NO3溶液中逐滴加入50 mL 0.020mol/L的盐酸(忽略溶液的体积变化),若AgCl的Ksp=c(Ag+)·c(Cl-)=1.0×10-10(mol/L)2,试求:
(1)沉淀生成后溶液中c(Ag+)_____▲______;
(2)沉淀生成后溶液的pH值_____▲______。
26.(12分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
① 将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2-3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从_____▲______色变为_____▲______色时,停止滴定。
 (2)滴定时边滴边摇动锥形瓶,眼睛应观察_____▲______;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_____▲______;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是_____▲______,由此造成的测定结果
_____▲______ (填偏高、偏低或无影响);
(4)步骤②缺少的操作是_____▲______;
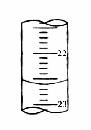
(5)右图,是某次滴定时的滴定管中的液面,其读数为_____▲______mL;
(6)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
25.00 |
0.50 |
20.40 |
|
第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度为_____▲______ mol/L
25.(6分)色谱分析法是现代分离实验技术中的一种,试回答下列问题
(1)已知两种有机色素A 与B混合在一起,经测定知A的极性比B强,则下列说法正确的是_____▲______;
A.用溶解过滤法,B不溶A溶于水
B. 用重结晶法,A在水中的溶解度比B大
C.用蒸馏法,因为A的熔沸点高
D.用纸层析法,丙酮为展开剂,下端为A,上端为B
(2)在用纸层法进行层析操作时,为什么不能让滤纸上的试样点接触展开剂?
__ ___▲___ ___
(3)纸层析法的原理是_____▲______。
A.萃取原理 B. 毛细现象 C. 蒸馏原理 D. 极性相似相溶原理
24.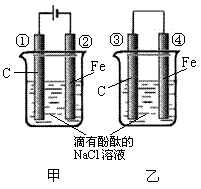 (8分)化学能和电能的相互转化,是能量转化的重要方式之一,右图两个实验装置是实现化学能和电能相互转化的装置。
(8分)化学能和电能的相互转化,是能量转化的重要方式之一,右图两个实验装置是实现化学能和电能相互转化的装置。
(1)把化学能转化为电能的装置是_____▲______(填“甲”或“乙”);
(2)④电极上的电极反应式为_____▲______;
(3)①电极上的电极反应式为 _____▲______,检验该电极反应产物的方法是
_____▲______;
(4)写出装置甲的反应总化学方程式___ __▲__ ____。
23.(8分)现有浓度为0.1 mol·L-1的五种电解质溶液 ① Na2CO3、② NaHCO3、③ NaAlO2
④ CH3COONa、⑤NaOH。已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-,试回答:
(1)这五种溶液的pH由大到小的顺序是___▲____
(填编号);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是_____▲______(填编号);
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是_____▲______(填编号);
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式_____▲______。
22.(10分)已知NO2和N2O4可以相
互转化:2NO2(g)
 N2O4(g);
N2O4(g);
△H<0。现将一定量NO2和N2O4的
混合气体通入一体积为1 L的恒温
密闭容器中,反应物浓度随时间变
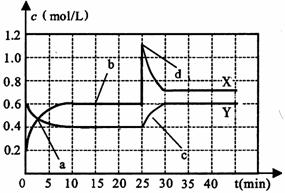
化关系如右图所示。回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线_____▲______表示N2O4浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是_____▲______。
(2)25 min~30 min内用NO2表示的平均化学反应速率v(NO2)=___▲____mol/(L·min);反应进行至25 min时,曲线发生变化的原因是_____▲______。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是 ▲ 。
A.升高温度 B.缩小容器体积
C.加入催化剂 D.加入一定量的N2O4
21. (4分)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式______▲_______,已知1mol液态水气化时需要吸收44kJ的热量,则1mol丁烷完全燃烧生成二氧化碳和水蒸汽时的ΔH为______▲_______。
(4分)用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式______▲_______,已知1mol液态水气化时需要吸收44kJ的热量,则1mol丁烷完全燃烧生成二氧化碳和水蒸汽时的ΔH为______▲_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com