
题目列表(包括答案和解析)
1.下列实验操作与安全事故处理错误的是
A.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残碎的温度计插入装有硫粉的广口瓶中
B.用试管夹从试管底由下往上夹住距试管口约1/3处,手持试管夹长柄末端进行加热
C.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
D.把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进孔中
25.(10分)(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同(如图8),Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g·mol-1)。
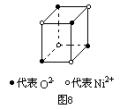
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷。例如在某种NiO晶体中就存在如图7所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍品组成为Ni0.97O,试计算该晶体中Ni3+与Ni2+的离子数之比。
24.(12分)键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC__________Si; SiCl4___________SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?____________(填“能”或“不能”),原因是__________________________
______________________________________________________________
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s)+4HCl(g)
计算该反应的反应热△H为__________________________
23.(12分)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式_________,F元素原子的电子排布式_____________,
E元素的原子结构示意图是__________________
(2)化合物乙中含有的化学键是____________________________
(3)化合物甲为固体时属于________晶体,E单质在一定条件下与甲反应的化学方程式为_________________________________________________。
22.(16分)根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),
回答下面各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是___________
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是____________
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____________
A.硼 B.铍 C.氦 D.氢
(4)T元素最可能是_______区元素,其氯化物的化学式为___________________
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________________________, 其中元素_______的第一电离能反常高的原因是
_________________________________________________________。
21.(10分)写出下列元素基态原子的电子排布式:
(1) N (2)Ne
(3) S (4)Ca
(5)Cu
20. 在x mol石英晶体中,含有Si-O键数是 ( )
A.x mol B.2x mo}
C.3 x mol D.4x mol
第Ⅱ卷 (非选择题共 60 分)
19. 下列叙述正确的是 ( )
A.同周期元素中,VIIA 族元素的原子半径最大
B.VIA 族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.同一周期中,碱金属的第一电离能最小
18.下列关于主族元素的说法正确的是
A.主族元素的原子核外电子最后填入的能级是s能级
B.主族元素的原子核外电子最后填入的能级是s能级或p能级
C.主族元素的最外层电子数等于主族的序数
D.主族元素的价电子数有可能超过最外层电子数
17.X、Y两元素可形成XY3型共价化合物,则X、Y最外层的电子排布可能是
A.X:3s23p1 Y:3s23p5 B.X:2s22p3 Y:2s22p4
C.X:3s23p1 Y:2s22p5 D.X:2s22p3 Y:1s1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com