
题目列表(包括答案和解析)
13. 合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 ①20MPa~50MPa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中 A.②③ B.②④ C.③ D.③④
12. 下列叙述中,正确的是 A.某特定反应的平衡常数仅是温度的函数而KW随浓度的改变而改变 B.一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 D.化学平衡发生移动,平衡常数必定发生变化
11.
化学反应C(s)+H2O(g)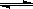 CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
A.减小压强,平衡向正反应方向移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.加入水蒸气使容器压强增大,平衡不移动
D.加入固体碳,平衡向正反应方向移动
CO(g)+H2(g);△H>0达到平衡,下列叙述正确的是
A.减小压强,平衡向正反应方向移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
C.加入水蒸气使容器压强增大,平衡不移动
D.加入固体碳,平衡向正反应方向移动
10. 某同学用一小块铝片和盐酸反应制取H2,实验现象如下表:
|
时间 |
1 min |
2 min |
5 min |
15 min |
20 min |
|
现象 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
反应1-15min内,铝与盐酸的反应速率变化的可能原因是 A.该反应是放热反应,温度升高 B.反应过程中盐酸的浓度增大 C.随着反应的进行,铝片表面积变小 D.Cl-离子是该反应的催化剂
9. 一定条件下的密闭容器中,进行如下反应:
NO(g)+CO(g) 
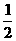 N2(g)+CO2(g);ΔH=-373.2 kJ/mol
为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
A.加(正)催化剂 B.增大压强(体积减小)
C.给体系加热
D.从体系中不断移去部分CO2
N2(g)+CO2(g);ΔH=-373.2 kJ/mol
为提高该反应的反应速率,缩短达到平衡的时间,下列措施不可取的是
A.加(正)催化剂 B.增大压强(体积减小)
C.给体系加热
D.从体系中不断移去部分CO2
8. 下列说法不正确的是 A.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4OH- B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 C.铸铁输油管道应埋在干燥致密不透气的土壤中 D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化
7. 为了避免青铜器生成铜绿,以下方法正确的是 A.将青铜器放在银质托盘上 B.将青铜器保存在潮湿的空气中 C.将青铜器与直流电源的正极相连 D.在青铜器的表面覆盖一层防渗的高分子膜
6. 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法不正确的是 A.原混合溶液中c(K+)为2 mol/L B.上述电解过程中共转移4 mol电子 C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为4 mol/L
5. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 A.电解稀硫酸制取氢气和氧气时,阳极的电极反应式:4OH--4e-=2H2O+O2↑ B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e-== 4OH- C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为: Cu2++2e- == Cu D.钢铁发生电化腐蚀的正极反应式:Fe -2e- == Fe2+
4. 下列各组热化学方程式中,化学反应的△H前者小于后者的是
①C(s)+O2(g)=CO2(g);△H1 C(s)+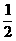 O2(g)=CO(g);△H2
②S(g)+O2(g)=SO2(g);△H3 S(s) +O2(g)=
SO2(g);△H4
③H2(g)+
O2(g)=CO(g);△H2
②S(g)+O2(g)=SO2(g);△H3 S(s) +O2(g)=
SO2(g);△H4
③H2(g)+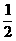 O2(g)=H2O(1);△H5 2H2(g)+O2(g)=2H2O(1);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(1)=Ca(OH)2(s);△H8
A.①② B.③④ C.②③④ D.①②③
O2(g)=H2O(1);△H5 2H2(g)+O2(g)=2H2O(1);△H6
④CaCO3(s)=CaO(s)+CO2(g);△H7 CaO(s)+H2O(1)=Ca(OH)2(s);△H8
A.①② B.③④ C.②③④ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com