
题目列表(包括答案和解析)
14.已知:C(s,金刚石)= C(s,石墨) △H=-1.9 kJ/mol
C(s,金刚石)+ O2(g) = CO2(g) △H1
C(s,石墨)+ O2(g) = CO2(g) △H2
根据已述反应所得出的结论正确的是( )
A、△H1=△H2 B、△H1<△H2 C、△H1>△H2 D、石墨比金刚石稳定
13. 下列反应属于吸热反应的是( )
A.生石灰投入到水中 B.Ba(OH)2·8H2O与NH4Cl反应
C.葡萄糖在人体内氧化分解 D.锌粒与稀H2SO4反应制取H2
12.已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l);ΔH=-571.6kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);ΔH=-2220kJ/mol
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放出热量3847kJ,则混合气体中氢气和丙烷的体积比约为( )
A. 1:3 B.1:4 C.1:1 D.3:1
11.已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g )=2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ C. 不能确定 D. 一定小于92.0 kJ
10.已知有热化学方程式:SO2(g)+ 1/2 O2(g) = SO3(g);△H =-98.32kJ/mol。现有4molSO2参加反应,当放出314.3kJ热量时,SO2的转化率最接近于 ( )
A、40% B、50% C、80% D、90%
9.强酸和强碱的稀溶液的中和热可表示为: H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H=-Q1kJ/mol
1/2 H2SO4(浓) +NaOH(aq)=1/2Na2SO4(aq) +H2O(1) △H=-Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H=-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为 ( )
A、Q1=Q2=Q3 B、Q2>Q1>Q3 C、Q2>Q3>Q1 D、Q2=Q3>Q1
8.醋酸电离要吸收热量,分别用40克氢氧化钠和盐酸、醋酸完全反应,放出的热量 ( )
A.相等 B.前者大于后者 C.前者小于后者 D.无法判断
7.已知(l)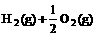 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
(2)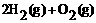 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
(3)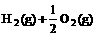 =H2O(l) △H3=c
kJ·
=H2O(l) △H3=c
kJ·
(4)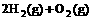 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
下列关系式中正确的是( )
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
6.已知充分燃烧a g乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-2b kJ / mol
B. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=-4b kJ / mol
C. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l); ΔH=2b kJ / mol2
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l); ΔH=b kJ / mol
5.下列热化学方程式中△H代表燃烧热的是( )
A. CH4 ( g ) + 3/2O2 ( g ) = 2H2O ( l ) + CO ( g ) △H1
B. S ( s ) + 3/2O2 ( g ) = SO3 ( s ) △H2
C. C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l ) △H3
D. 2CO ( g ) + O2 ( g ) = 2CO2 ( g ) △H4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com