
题目列表(包括答案和解析)
30.t℃时,甲、乙两个烧杯中各盛有200g 相同浓度的硝酸钾溶液。现将甲烧杯中的溶液蒸发掉20g 水,恢复到t℃时析出KNO3固体8g ;乙烧杯中的溶液蒸发掉40g水,恢复到t℃时析出KNO3固体20g。
(1)乙烧杯中剩余KNO3溶液的物质的量浓度_______甲烧杯中剩余KNO3溶液
物质的量浓度 (填大于、小于、等于或无法确定)
(2)t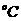 时 KNO3的溶解度为_________________g/100g水
时 KNO3的溶解度为_________________g/100g水
(3) 求原溶液中溶质的质量分数(要求计算过程)

29.在一容积为2升的密闭容器内加入0.2 mol的N2和0.6 mol 的H2,
在一定条件下发生如下反应: N2 + 3H2 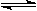 2NH3(g )+ Q
2NH3(g )+ Q
反应中NH3的物质的量浓度的变化的情况如下图:
浓度(mol/L)
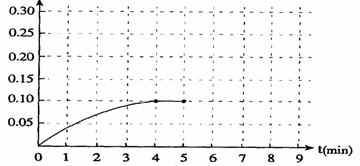
(1) 在图上作出0到5分钟内H2的浓度变化曲线
(2) 根据上图数据,反应开始至达到平衡时,平均速率υ(N2)为_________ mol/(L·min)。
(3) 反应达到平衡后,第5分钟时,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 (填序号) 。
A、0.20 mol/L B、0.16 mol/L
C、0.10 mol/L D、0.05 mol/L
(4)反应达到平衡后,第5分钟时,保持其它条件不变,若只把容器的体积缩小一半,
平衡 移动(填“向左”、“向右”或“不”),
下列有关说法正确的是
a 氢气的浓度减少 b 正反应速率减小,逆反应速率加快
c 容器中气体的密度将增大 d 重新平衡时与原平衡相比n(H2)/n(NH3)减小
若在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线。
28.影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
实验一:甲同学利用Al、Fe、Mg和2 mol/L硫酸,设计实验方案研究影响反应速率的因素。
(1) 甲同学研究的实验报告如下表:
|
实 验 步 骤 |
现 象 |
结 论 |
|
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Al、Fe、Mg。 |
反应快慢: Mg> Al> Fe |
反应物的性质越活泼,反应速率越快。 |
该同学实验的目的是________________________________________________________;
要得出正确的实验结论,还需控制的实验条件是___ _____ 。
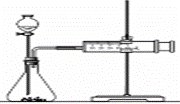
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置在同温下进行定量实验。用大小、形状相同的Fe分别和0.5mol/L及2mol/L的足量稀硫酸反应。
通过 可以说明浓度对反应速率的影响
实验二:已知2KMnO4+5H2C2O4+3H2SO4 → K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(3) 针对上述实验现象,某同学认为该反应放热,导致溶液温度升高,反应速率加快。 从影响化学反应速率的因素看,你的猜想还可能是_______ 的影响。
(4) 若要用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还可以在反应已开始时加入 ( )
A、硫酸钾 B、硫酸锰 C、水
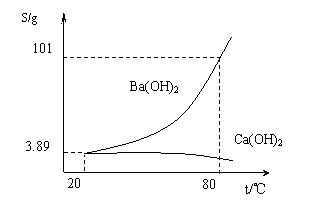
27.实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
(1)高温灼烧碳酸钡和碳酸钙的混合物,直至完全分解。
(2)将灼烧后的固体混合物置于80 ℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 。
此操作所需的玻璃仪器有_______________________________________________。
(3)将“(2)”中滤液 并过滤,得到的Ba(OH)2固体。分析上图可知:
80 ℃时Ba(OH)2的饱和溶液828克冷却到20 ℃,可析出Ba(OH)2(不含结晶水)
_________________克。(答案取整数)
(4)将(3)得到的Ba(OH)2固体溶于水制成溶液,滴加酚酞试剂,再通入二氧化碳,当观察到 时,即可停止通二氧化碳。
(5) 经过滤、_________、 后即得到纯净的碳酸钡。
26.现有部分短周期主族元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
原子M层上有2对成对电子 |
|
B |
元素最高正价是+7价 |
|
C |
原子核外p电子数与s电子数相等,且具有四种不同能量的电子 |
|
D |
原子3p亚层上有一个未成对电子,常温下单质呈固态 |
① 用元素符号将B、D两元素填写在下面元素周期表中对应位置。
② 元素A的原子最外层共有 种不同运动状态的电子。
③ 元素B的阴离子的电子式为___________ 其气态氢化物的电子式为_________
④ 在元素C的单质、元素D的单质和元素C、D形成的合金这三种物质中,熔点最高的的是_______________ 。(填物质名称)
⑤ A元素与B元素相比较,非金属性较强的是 (填名称),
下列表述中不能证明这一事实的是( )
a. 在溶液中B的单质能置换出A的单质
b. B的气态氢化物比A的气态氢化物稳定
c. B的气态氢化物的沸点比A的气态氢化物高
d. 在B与A形成的共价化合物分子中共用电子对偏向B原子
⑥ 某同学猜想D和B形成的化合物晶体类型与NaCl相同,则其熔沸点应 (填“高于”或“低于”)NaCl。
如果用实验证明上述猜想不正确,你的实验方案是:
25.对于密闭容器中的反应:N2(g )+3H2(g) 2NH3(g)+Q. 673K、30Mpa下
2NH3(g)+Q. 673K、30Mpa下
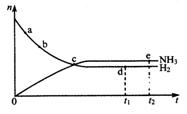 n(NH3)和n(H2) 随时间变化的关系如图所示。
n(NH3)和n(H2) 随时间变化的关系如图所示。
下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小
24.下列事实中,不能用勒夏特列原理解释的是( )
A.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
B.由H2(g)、I2(g)、HI(g)组成的平衡体系,加压后颜色加深
C.实验室常用排饱和食盐水的方法收集氯气
D.及时分离从合成塔中出来的混合气,有利于合成氨
23.对于密闭容器中进行的反应,CO(g)+H2O(g)
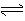 CO2(g)+H2(g)+Q,
CO2(g)+H2(g)+Q,
改变下列条件,平衡一定正向移动的是( )
A.增大压强 B.通入CO2 C.降温 D.加入催化剂
22. 在恒温下的体积固定的密闭容器中, 有可逆反应: A(s)+2B(g) 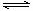 C(g)+D(g)
C(g)+D(g)
下列各项中不能说明该可逆反应已经达到平衡的是( )
A.容器内气体的密度不随时间变化而变化
B. 2v正(B)=v逆(C)
C.混合气体的平均分子量不随时间变化而变化
D. A的质量百分数不随时间变化而变化
21.设 C(固)+CO2 2CO- Q1 反应速度为V1;
2CO- Q1 反应速度为V1;
N2 + 3H2 2NH3+Q2 反应速度为V2,
2NH3+Q2 反应速度为V2,
对于上述反应,当压强减小时,V1和V2的变化情况为 ( )
A.同时增大 B.同时减小 C.V1增大,V2减小 D.V1减小,V2增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com