
题目列表(包括答案和解析)
23.(6分)1949年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示:呈V型,键角116.5° 。三个O原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键(虚线内部分)- 三个O原子均等地享有这4个电子。请回答:
(1)题中非极性共价键是 键,特殊的化学键是 键。(填“σ”或“π”)
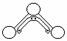 (2)下列物质的分子与O3分子的结构最相似的是 。
(2)下列物质的分子与O3分子的结构最相似的是 。
A.H2O B.CO2 C.SO2 D.BeCl2
22.(8分)有机物A(C6H8O4)为食品包装纸的常用防腐剂。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到没有支链B(C4H4O4)和甲醇。通常状况下B为无色晶体,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有 (选填序号)。
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子中没有支链,其结构简式是 ,B的具有相同官能团的同分异构体的结构简式是 。
(3)天门冬氨酸(C4H7NO4)是组成人体蛋白质的氨基酸之一,可由B通过以下反应制取:
B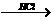 C
C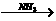 天门冬氨酸。 则天门冬氨酸的结构简式是
。
天门冬氨酸。 则天门冬氨酸的结构简式是
。
21.(4分)在HF、H2O、NH3、CH4、N2、CO2、HI分子中:
(1)以非极性键结合的非极性分子是 。
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有折线型结构的极性分子是 。
20、 维生素C是一种水溶性维生素(其水溶液呈酸性)化学式为C6H8O6,结构如下图所示。人体缺乏这种维生素C易得坏血症,所以维生素C又称抗坏血酸。维生素C易被空气中的氧气氧化。在新鲜的水果、蔬菜、乳制品中都含维生素C,如新鲜的橙汁中维生素C的含量在500mg/L左右。下列关于维生素C的叙述错误的是
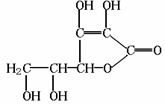 A.维生素C能使溴水褪色
A.维生素C能使溴水褪色
B.维生素C可作食品添加剂
C.维生素C可发生水解反应
D.维生素C不能发生氧化反应
第Ⅱ卷(非选择题 共80分)
19、实验测得 BeCl2为共价化合物,两个Be-Cl键间的夹角为180°。由此可见,BeCl2属于
A.由极性键构成的极性分子 B.由极性键构成的非极性分子
C.由非极性键构成的极性分子 D.由非极性键构成的非极性分子
18.2002年瑞典科学家发现,某些高温油炸食品中含有一定量的CH2=CH-CO-NH2(丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:① 能使酸性KMnO4溶液褪色 ② 能发生加聚反应 ③ 能发生缩聚反应 ④只有4种同分异构体 5能与氢气发生加成反应。其中正确的是
A. ①②③ B . ②③④ C . ①③④ D . ①②5
17、下列关于蛋白质的叙述中,正确的是
A、蛋白质溶液里加(NH4)2SO4溶液可提纯蛋白质
B、在豆浆中加少量石膏,能使豆浆凝结为豆腐
C、温度越高,酶对某些化学反应的催化效率越高
D、任何结构的蛋白质遇到浓HNO3都会变为黄色
16.下列说法中正确的是
A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 B.P4和CH4都是正四面体分子且键角都为109o28ˊ C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 D.原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度
15.下列有关金属的说法正确的是
A.金属原子的核外电子在金属晶体中都是自由电子
B.镁型和铜型的原子堆积方式空间利用率最高
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.温度升高,金属的导电性将变小
14.现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.氢化物稳定性:③>①>② D.最高正化合价:③>②>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com