
题目列表(包括答案和解析)
6.20℃时,向100g水中不断加入KNO3固体,充分搅拌后过滤,称量所得溶液的质量,如下表所示。试分析下列四组溶液哪些是饱和溶液?哪些是不饱和溶液?
|
选项 |
A |
B |
C |
D |
|
加入KNO3质量(g) |
5 g |
15 g |
31.6 g |
35 g |
|
所得溶液质量(g) |
105 g |
115 g |
131.6 g |
131.6 g |
5.20℃时,下列四种物质分别溶解在水里恰好制成饱和溶液。其中易溶物质是( )
A.1g物质溶解在100g水里 B.15g物质溶解在1000g水里
C.20g物质溶解在150g水里 D.100g水里溶解0.5g物质
4.常温下,向一未知质量分数的硝酸钾溶液中加入少量硝酸钾晶体,经充分搅拌,发现有部分硝酸钾晶体溶解。原溶液是( )
A.饱和溶液 B.不饱和溶液
C.各部分性质不相同的液体 D.无法确定
3.可以证实某硝酸钾溶液是20℃时的饱和溶液的事实是( )
A.降温到10℃时,有硝酸钾晶体析出
B.蒸发掉10g水,有硝酸钾晶体析出
C.20℃时,向原溶液中加入少量硝酸钾晶体,溶液中硝酸钾的质量分数不变
D.加热到30℃后,再加入硝酸钾晶体能继续溶解
2.欲将某温度下的KNO3饱和溶液转化为不饱和溶液,下列方法可行的是( )
A.加入KNO3晶体 B.加水
C.降低温度 D.恒温蒸发水分
1.下列因素:①温度 ②固体物质的种类 ③水的质量 ④ 固体物质的颗粒大小,其中不影响固体物质在水中的溶解度的有( )
A.①④ B.②③ C.①② D.③④
3.审题不细,特别是对选择题的要求看得不够认真,如把“关于……的说法正确的是”看成是“关于……的说法不正确的是”,或把“不能说明……的是”看作为“能说明……的是”,如例1、例4等。
[基础演练]
2.对溶解度曲线的含义与利用缺少全面的认识,方法上不得要领。要把握住溶解度曲线的交点的意义,知道比较不同物质的溶解度大小需要在相同的温度下进行,理解曲线的陡、缓反映的是受温度影响的情况。如例3。
1.忽视饱和溶液、不饱和溶液、溶解度等概念的前提条件,未能真正理解这些概念的含义,从而导致在对某些说法的判断上不能作出正确的选择。如例1、例2。
4.影响气体物质溶解度的因素的分析及以此解释生活中的某些现象,如例4。
例1.下列有关固态物质饱和溶液的说法正确的是( )
A.饱和溶液就是不能继续溶解溶质的溶液
B.同一溶质的饱和溶液一定比不饱和溶液浓
C.将热饱和溶液降温时,一定会析出晶体
D.饱和溶液在一定条件下可转化为不饱和溶液
解析 :此题主要考查“饱和溶液”的概念。在理解这个概念时,要注意(溶质为固态)如下几个关键:①一定温度、一定量的溶剂;②同种溶质溶解的量不能继续增加(但其它溶质可以继续溶解)。比较同种溶质的饱和溶液、不饱和溶液的浓稀,一定要在同温下进行比较。如A中未指明“一定温度”、“一定量的溶剂”,也未指明是不是同种溶质,故不正确。B中未指明“相同温度”,也不正确。C中因为并不是所有的物质的溶解度都是随温度的降低而减小的,有些溶质的溶解度(如氢氧化钙)是随温度升高而减小的,故C不正确。
答案:D。
例2.“20℃时食盐的溶解度是36g”。根据这一条件及溶解度的含义,判断下列说法哪一种是正确的( )
A.100g水溶解36g食盐恰好能配成饱和溶液
B.200C时,100g食盐饱和溶液里含有36g食盐
C.200C时,把136g食盐饱和溶液蒸干,可得到36g食盐
D.饱和食盐水溶液中溶质、溶剂、溶液的质量比为36:100:136
解析:本题重在考查大家对于溶解度概念的理解。溶解度这一概念有如下四个要点:一定的温度;100g溶剂;达到饱和状态;质量单位(g)。根据溶解度的概念并结合题给条件可知,A的说法是不正确的,原因在于没有指明温度这一条件;按照溶解度的含义,在20℃时将36g食盐溶于100g水中恰好达到饱和状态,这时所得到的食盐饱和溶液的质量为136g;相反,如果将这136g的食盐饱和溶液蒸干,一定就能得到36g食盐;同样,由于在136g食盐饱和溶液里含有36g食盐,那么,在100g食盐饱和溶液里就不可能含有36g食盐了(肯定比36g要少)。至于饱和食盐水溶液中溶质、溶剂、溶液的质量之比,如果没有温度这一前提条件,就无法进行相应的求算。
答案:C。
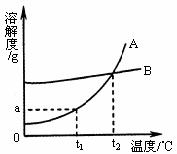 例3. A、B两种固体物质的溶解度曲线如图所示。请回答: (1)
例3. A、B两种固体物质的溶解度曲线如图所示。请回答: (1)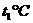 时,A物质的溶解度为 g。
时,A物质的溶解度为 g。
(2)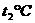 时,A、B两种物质的溶解度
时,A、B两种物质的溶解度
(填“相同”或“不同”)。
(3)我国有些地区有一种说法:“冬天捞碱,夏天晒盐”。这里的碱是指Na2CO3,盐是指NaCl。那么,图中 (填A或B)的溶解度曲线与Na2CO3的溶解度曲线相似。人们用上述方法从盐湖中捞得的Na2CO3会含有少量的NaCl。某研究性学习小组称取含NaCl的Na2CO3固体12.5g,将其配制成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,共收集到4.4g CO2气体,则原固体中Na2CO3的质量分数为多少? 。
解析:本题重在考查大家对于溶解度曲线的认识与利用的能力,同时涉及到根据化学方程式的计算问题。我们知道,溶解度曲线是以实验数据为依据,用纵坐标表示溶解度,横坐标表示温度,绘出的物质的溶解度随温度变化的曲线。利用溶解度曲线,可以查出某物质在不同温度下的溶解度;也可以查出同一温度下不同物质的溶解度;还可以比较不同的物质在同一温度下溶解度的大小;若两条曲线相交,则其交点表示在该温度下这两种物质的溶解度大小相等。当然,根据溶解度曲线还能看出某物质的溶解度受温度变化的影响情况。
由所给A、B两种固体物质的溶解度曲线可以看出,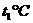 时,A物质的溶解度为a g;
时,A物质的溶解度为a g;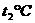 时,A、B两种物质的溶解度是相同的;既然冬天能“捞碱”,这就说明碳酸钠的溶解度受温度的影响是比较大的,因此其溶解度曲线应当与A相似;通过根据碳酸钠与盐酸反应的化学方程式不难求得原固体中Na2CO3的质量分数为84.8%。
时,A、B两种物质的溶解度是相同的;既然冬天能“捞碱”,这就说明碳酸钠的溶解度受温度的影响是比较大的,因此其溶解度曲线应当与A相似;通过根据碳酸钠与盐酸反应的化学方程式不难求得原固体中Na2CO3的质量分数为84.8%。
例4.生活中的下列现象不能说明气体溶解度随温度升高而减小的是 ( )
A.烧开水时,沸腾前有气泡逸出
B.喝下汽水感到有气体冲出鼻腔
C.揭开啤酒瓶盖,有大量的泡沫溢出
D.夏季黄昏,池塘里的鱼常浮出水面
解析:气体物质在水中的溶解度受温度及压强的影响,温度越高,气体的溶解度越小;压强越大,气体的溶解度越大。根据影响气体物质溶解度的的因素,可以解释生活中的某些现象;反之,通过某些现象也可以说明外界条件对于气体溶解度的影响。对比四个选项不难知道,A、B、D都说明了气体的溶解度是随着温度的升高而减小的,唯有C表明了在压强减小时,气体的溶解度也变小,与题干的要求不符,这正是本题的答案。
答案:C。
[常见误区]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com