
题目列表(包括答案和解析)
22.实验室常用饱和的NaNO2和NHCl溶液反应制取纯净的氮气用于合成氨气,反应式为NH4Cl+NaNO2 NaCl+2H2O+N2。实验装置如图所示,试回答:
NaCl+2H2O+N2。实验装置如图所示,试回答:
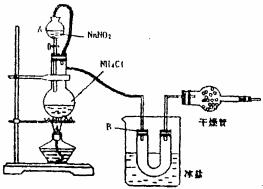 (1) 装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用
(填编号)
(1) 装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用
(填编号)
a. 防止NaNO2饱和溶液蒸发
b. 保证实验装置不漏气
c. 使NaNO2饱和溶液容易滴下
(2) B部分的作用是
a. 冷凝
b. 缓冲气流
c. 冷却氮气
(3) 加热前必须进行的一个操作步骤是(用文字说明) 加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 (用文字说明)
 (4) 收集N2前,必须进行的步骤是(用文字说明)
,收集氮气最适宜的方法是
。
(4) 收集N2前,必须进行的步骤是(用文字说明)
,收集氮气最适宜的方法是
。
a. 用排空气法收集在集气瓶中
b. 用排水法收集在集气瓶中
c. 直接收集在球胆或塑料袋中
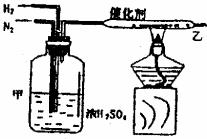
(5) 实验室合成氨装置如图所示,试回答:装置甲的作用是
a.
b.
c.
从乙处导出的气体是
21.下面是某学生用已知浓度的盐酸溶液测定未知浓度的NaOH溶液的部分操作,其中错误的是
A. 取一锥形瓶,用待测NaOH溶液润洗两次后装入25 mL待测NaOH溶液
B. 加入几滴石蕊试液作指示剂
C. 取一支酸式滴定管,洗涤干净后直接往其中注入标准盐酸溶液
D. 滴定时,两眼注视滴定管内盐酸溶液液面下降,直至滴定终点
20.下列方程式属于水解反应的是 ( )
A. H2O+H2O 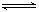 H3O++H+
H3O++H+
B. 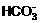 +H2O
+H2O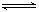 H3O++
H3O++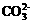
C. 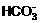 +OH-=H2O+
+OH-=H2O+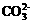
D. 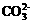 +H2O
+H2O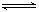
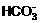 +OH-
+OH-
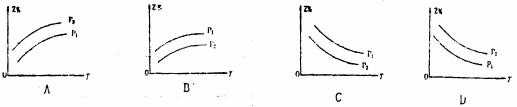
19.如图所示,反应X(g)+3Y(g)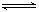 2Z(g)+Q,在不同温度、不同压强( P1<P2)下,达到平衡时,混合气体中Z的体积分数Z%随温度变化的曲线应为
( )
2Z(g)+Q,在不同温度、不同压强( P1<P2)下,达到平衡时,混合气体中Z的体积分数Z%随温度变化的曲线应为
( )
17.在Na2S溶液中存在的下列关系正确的是 ( )
A. c(Na+)=c(S2-) B. c(Na+)∶c(S2-)=2∶1
C. c(Na+)∶c(S2-)>2∶1 D. c(Na+)∶c(S2-)<2∶1
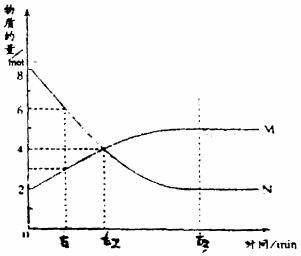 18.在一定温度下容器内某一反应中,M、N的物质的量随时间变化的曲线如图,所示下列表述中正确的是
( )
18.在一定温度下容器内某一反应中,M、N的物质的量随时间变化的曲线如图,所示下列表述中正确的是
( )
A. 反应的化学方程式为2M=N
B. t2时的正逆反应速率相等,达到平衡
C. t3时的正反应速率大于逆反应速率
D. t1时N的浓度等于M的浓度的2倍
16.某无色透明溶液能与Al反应析出H2,则此溶液中可能大量存在的是 ( )
A. OH-、Ba2+、Cl-、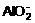 B. H+、Mg2+、
B. H+、Mg2+、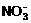 、Na+
、Na+
C. H+、Cu2+、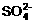 、K+
D. H+、Cl-、
、K+
D. H+、Cl-、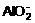 、Mg2+
、Mg2+
15.根据下列化学方程式
① 2 十16H+十10Cl-=2Mn2+十8H2O十5Cl2
十16H+十10Cl-=2Mn2+十8H2O十5Cl2
② 2Fe2++Cl2=2Fe3++2Cl-
③ 2Fe3++Cu=2Fe2++Cu2+
④ Fe+Cu2+=Fe2++Cu
可推断 、Fe2+、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为
( )
、Fe2+、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为
( )
A.  >Cl2>Fe3+>Cu2+>Fe2+
>Cl2>Fe3+>Cu2+>Fe2+
B. Fe3+> >Cl2>Cu2+>Fe2+
>Cl2>Cu2+>Fe2+
C. Cl2> >Fe3+>Cu2+>Fe2+
>Fe3+>Cu2+>Fe2+
D. Cu2+>Cl2> >Fe3+>Fe2+
>Fe3+>Fe2+
14.已知一种pH=3的酸和一种pH=11的碱以等体积混合后溶液呈酸性,其原因可能是 ( )
A. 浓的强酸溶液和稀的强碱溶液反应
B. 浓的弱酸溶液和稀的强碱溶液反应
C. 等物质的量浓度的强酸溶液和弱碱溶液反应
D. 生成了一种强酸弱碱盐
13.20℃时H2S饱和溶液1 L,其浓度为0.1 mol / L,其电离方程式为H2S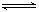 H++HS-,HS-
H++HS-,HS-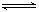 H++S2-,若要使溶液的pH值和[]减小,可采取的措施是
( )
H++S2-,若要使溶液的pH值和[]减小,可采取的措施是
( )
A. 通入适量的H2S气体 B. 加入少量的氢氧化钠固体
C. 加入适量的CuSO4固体 D. 加入适量水
12.在一定温度下的固定容积的密闭容器中,反应A2(g)+B2(g)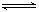 2AB(g),达到平衡的标志是
( )
2AB(g),达到平衡的标志是
( )
A. 单位时间内生成n mol A2,同时生成n mol AB
B. 容器内的总压强、密度和平均相对分子质量均不随时间变化
C. 容器内A2、B2、AB的物质的量之比1∶1∶2
D. 单位时间内生成2n mol的AB同时生成n mol的B2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com