
题目列表(包括答案和解析)
1.下列物质使用不合理的是
A、用白磷制安全火柴 B、液氨作致冷剂
C、明矾用作工业用水的净水剂 D、金的合金用于制造笔尖材料
24.(8分)在一定温度下,将N2和H2的混合气体100 mol通入密闭的容器中,达到平衡时,容器内压强比反应前减少了1/5,又测得此时混合气体的平均相对分子质量为9,试求:(计算结果取整数)
(1)平衡时NH3的物质的量?
(2)原混合气体中N2和H2的物质的量?
(3)H2的转化率为多少?
23.(12分)某兴趣小组设计出如图所示装置来改进教材中“铜与硝
酸反应”实验,以探究化学实验的“绿色”化。
(1) 实验前,关闭活塞b,向试管d中加水至浸没长导气管口,
塞紧试管c和d的胶塞,然后加热c,其目的是______________。
(2) 在d中加适量 NaOH 溶液,c中放一小块铜片,由分液
斗a向c中加入2mL浓硝酸,c中反应的化学方程式是_______ 。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_______,
理由是___________________。
|
方案 |
甲 |
乙 |
丙 |
|
反应物 |
Cu、浓HNO3 |
Cu、稀HNO3 |
Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,为此应由a向c中加入_______,c中应盛有________,d中应盛有________;但此实验的不足之处是______。
22.(6分)在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),已知加入1mol A和3mol B反应达到平衡后,生成了a mol C。
3C(g),已知加入1mol A和3mol B反应达到平衡后,生成了a mol C。
(1)在相同实验条件下,若在同一容器中改为加入2mol A和6 mol B,达到平衡后,C的物质的量为 mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比 (选填“增大”“减小”或“不变”)。
(2)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C mol。
21.(4分)把3体积NO2气体依次通过装有足量NaHCO3饱和溶液、浓H2SO4和Na2O2的三个装置,最后用排水法收集所得气体,假设氮的氧化物不与Na2O2反应,最后收集到 体积的气体(同温同压下),该气体的组成为 。
20.(8分)(1)配平:__NO2- +__MnO4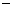 +__H
+__H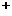 == __Mn
== __Mn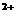 +__NO3- +__H2O
+__NO3- +__H2O
(2)请将:N2O、Cu2S、CuSO4、HNO3、Cu(NO3)2五种物质分别填入下面对应的横线上,并配平。
_________+__________ == __________+__________+ ________ + H2O
反应中1 mol氧化剂_______(填“得到”或“失去”)_______ mol电子。
19.(8分)在一定条件下,可逆反应:mA+nB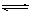 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)。
18.某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:
n(NO3-):n(SO42-):n(Fe3+): n(H+):n(X) == 2:3:1:3:1,则X可能为 ( )
(A) Fe2+ (B) Mg2+ (C) Cl- (D) Ba2+
第Ⅱ卷(共46分)
17. 25 ℃时,水的电离达到平衡:H2O H++OH-;DH>0,下列叙述正确的是( )
H++OH-;DH>0,下列叙述正确的是( )
(A)向水中加入稀氨水,平衡逆向移动,c(OH-)降低
(B)向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
(C)水电离产生的c(H+)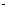 c(OH-) = 10-26的溶液中加入锌粒,一定放出H2
c(OH-) = 10-26的溶液中加入锌粒,一定放出H2
(D)将水加热,KW增大,pH不变
16.下列叙述正确的是 ( )
(A)95 ℃纯水的pH<7,说明加热可使水呈酸性
(B)pH = 3的醋酸溶液,稀释至10倍后pH = 4
(C)0.2 mol·L-1的盐酸,与等体积水混合后pH = 1
(D)pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com