
题目列表(包括答案和解析)
8、铜的冶炼大致可分为:⑴富集:将硫化物矿进行浮选;⑵焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2↑+2FeO(炉渣);⑶制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑;⑷电解精炼铜。下列说法正确的是
A.上述灼烧过程的尾气均可直接排入空气
B.由6molCuFeS2生成6molCu,反应共消耗15molO2
C.反应2Cu2O+ Cu2S=6Cu+SO2↑中,氧化剂只有Cu2O
D.电解精炼铜时,粗铜应与外电源负极相连
7、520℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中不正确的是
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为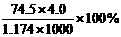
C.20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm━3
6、阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中不正确的是
A.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
B.标准状况下,a L甲烷和乙烷混合气体中的分子数约为a/22.4×6.02×1023
C.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
D.电解食盐水若产生2g氢气,则转移的电子数约为2×6.02×1023
5.假如把质量数为12的碳原子(12C)的相对原子质量定为24,并用以确定相对原子质量,以0.024Kg 12C所含的碳原子数为阿伏加德罗常数。下列数值:①浓H2SO4的物质的量浓度;②氧气的溶解度;③气体摩尔体积;④阿伏加德罗常数;⑤氧元素的相对原子质量,肯定不变的是
A.①② B.③④ C.④⑤ D.②
4、下列各项表达正确的是
A.H2O的分子模型示意图: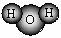 B.F-的结构示意图:
B.F-的结构示意图: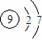
C.乙烯分子的结构简式:CH2CH2
D.CaCl2的电子式: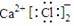
3、下列表中对于相关物质的分类全部正确的一组是
|
编号 |
盐 |
酸 |
弱电解质 |
非电解质 |
|
A |
Na2SO4 |
H2SO4 |
NaHCO3 |
CO2 |
|
B |
NaHSO4 |
CH3COOH |
SO2 |
CH3CH2OH |
|
C |
FeCl3 |
NaHSO4 |
H2SiO3 |
Cl2 |
|
D |
Ba(NO3)2 |
H3PO4 |
H2CO3 |
NH3 |
2、以下实验或操作不能达到目的的是
A.用溴水鉴别苯、乙醇、四氯化碳
B.准确称取0.4000 g的NaOH固体配成1000 mL浓度为0.01000 mol·L-1的溶液
C.为除去苯中的少量苯酚,向混合物中加入适量的溴水后过滤
D.用激光笔检验淀粉溶液的丁达尔现象
1、含NA代表阿伏伽德罗常数,下列叙述错误的是
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2 NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1NH4Cl溶液与2 L0.25mol·L-1NH4Cl溶液NH4+物质的量不同
33.(6分)在500mLCuSO4和Fe2(SO4)3的混合溶液中加入16.8g铁粉,搅拌并充分反应后,经过滤、洗涤、干燥,可得6.4g铜。要使滤液中SO42-完全沉淀,需加入2.0mol/LBaCl2溶液500mL。已知Fe3+的氧化性比Cu2+强,求:(1)原混合溶液中SO42-的物质的量浓度。(2)原混合溶液中CuSO4和Fe2(SO4)3的物质的量浓度。
32.(5分)有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)如果加入蒸馏水,就加入____▲____ mL
(2)如果加入pH = 10的NaOH溶液,应加入__▲____ mL
(3)如果加入0.008 mol/L HCl溶液,应加入___▲_____ mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com