
题目列表(包括答案和解析)
4.在水中加入下列物质,可使水的电离平衡向电离方向移动的是 ( )
A、硫酸 B、氢氧化钾 C、氯化铁 D、硝酸钡
3.下列溶液中一定显碱性的是 ( )
A.滴加甲基橙后溶液显红色 B.溶液的pH>7
C.滴加甲基橙后溶液显黄色 D.溶液中:c(OH─)>c(H+)
2.下列试纸使用时, 不宜先用水润湿的是 ( )
A、pH试纸 B、红色石蕊试纸 C、淀粉碘化钾试纸 D、蓝色石蕊试纸
1.纯水在25℃和80℃时的氢离子浓度,前者和后者的关系是 ( )
A、前者大 B、相等 C、前者小 D、不能肯定
6、(8分)将40g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
5、(6分)用18 mol·L-1硫酸配制100 mL 1.0 mol·L-1的硫酸,若实验仪器有:A.100 mL量筒 B.托盘天平C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号) 。
(2)在容量瓶的使用方法中,下列操作不正确的是 。(填写标号)
A、使用容量瓶前检查它是否漏水。
B、容量瓶用蒸馏水洗净后,再用待配溶液润洗。
C、配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2 cm-3 cm处,用滴管滴加蒸馏水到标线。
D、配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线2 cm-3 cm处,用滴管滴加蒸馏水到标线。
E、盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次。
4、(12分)小苏打、胃舒平、达喜都是常用的中和胃酸的药物。
(1)小苏打片每片含0.50 gNaHCO3,2片小苏打片和胃酸完全中和,被中和的氢离子是 mol。
(2)胃舒平每片含0.245 g Al(OH)3。中和胃酸时,6片小苏打片相当于胃舒平 片。
(3)达喜的化学成分是铝和镁的碱式盐。
①取该碱式盐3.01 g,加入2.0 mol·L-1盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时正好反应完全,计算该碱式盐样品中氢氧根与碳酸根的物质的量之比。
②在上述碱式盐溶于盐酸后的溶液中加入过量氢氧化钠,过滤,沉淀物进行干燥后重1.74 g,若该碱式盐中氢元素的质量分数为0.040,试推测该碱式盐的化学式。
3、(12分)在热的稀硫酸溶液中溶解了11.4 g FeSO4。当加入50 mL 0.5 mol·L-1 KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
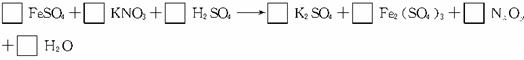
(1)推算出x=___________ ,y=___________。
(2)配平该化学方程式(系数填写在上式方框内)。
(3)反应中氧化剂为___________。
(4)用短线和箭头标出电子转移的方向和总数。
2、(14分)工业上制备单质碘的方法之一是从碘酸盐开始的。第一步先用适量的亚硫酸氢盐将碘酸盐还原成碘化物,离子方程式为:IO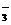 +3HSO
+3HSO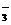 ====I-+3SO
====I-+3SO +3H+。第二步将第一步得到的酸性碘化物溶液再跟适量的碘酸盐溶液混合,发生反应析出了碘。试问:
+3H+。第二步将第一步得到的酸性碘化物溶液再跟适量的碘酸盐溶液混合,发生反应析出了碘。试问:
(1)第二步发生反应的离子方程式是:__________________________。
(2)若要使碘酸盐的利用率最高,碘酸盐在第一步和第二步反应中的用量之比为____。
(3)①配平下列离子方程式:
Fe(OH)3+ ClO-+ OH--- FeO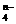 + Cl-+ H2O
+ Cl-+ H2O
②已知有3.21 g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______________,FeO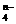 中铁的化合价为_____________。
中铁的化合价为_____________。
③根据(1)(2)推测,FeO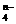 能和下列________________(只填序号)物质反应。
能和下列________________(只填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
1、(12分)(1)在反应2KMnO4+16HBr====5Br2+2MnBr2+2KBr+8H2O中,还原剂是___。
(2)已知BrFx与H2O按物质的量之比3∶5反应的产物是HF、HBrO3、Br2、O2,该反应中的氧化剂是____________,还原剂是___________,BrFx中的x=___________。
(3)浓盐酸在反应KClO3+HCl-KCl+ClO2+Cl2 +H2O中显示出来的性质是______。
(4)常温下,下列反应均能自发地向右进行:2D-+A2====D2+2A-;2B-+D2====B2+2D-;2A-+C2====A2+2C-。由此得出的正确结论是( )
A、A-、B-、C-、D-离子中,还原性最强的是C-
B、A2、B2、C2、D2单质中,氧化性最强的是C2
C、反应2C-+Br2====C2+2B-不能自发向右进行
D、反应2C-+Br2====C2+2B-能够自发向右进行
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com