
题目列表(包括答案和解析)
25.Cu和Fe2O3的混合物粉末22.4g加入到1mol/LH2SO4溶液中,充分反应后,
(1)若固体恰好全部溶解,消耗H2SO4的体积为VL,求V的取值范围
(2)若H2SO4溶液过量,反应后溶液体积为1L,测得此溶液中C(Fe2+)=0.1mol/L,求原混合物中含Cu多少克?
24..自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
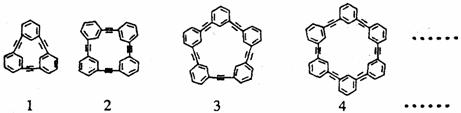
(1)上述系列中第2种物质的分子式为 。
(2)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为 。
(3)在实验中,制备上述系列化合物的原料苯乙炔可用苯乙烯(CH2=CH- )为起始物质制得。请结合下列反应规律:CH3CH2Cl+NaOH
)为起始物质制得。请结合下列反应规律:CH3CH2Cl+NaOH CH2=CH2↑+NaCl+H2O写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
CH2=CH2↑+NaCl+H2O写出由苯乙烯制取苯乙炔的化学方程式(所需的无机试剂自选)
23.烷烃分子中,与碳原子相结合的氢原子有3个,2个,2个等不同情况,分别用伯氢、仲氢、叔氢加以区别,如下式所示: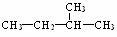 。在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的几率(机会)不同,但同类氢原子被取代的几率(机会)可视为相同。现将nmol 2-甲基丁烷与适量溴蒸气在一定条件下完全反应,若只生成四种一溴代物和溴化氢,则
。在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的几率(机会)不同,但同类氢原子被取代的几率(机会)可视为相同。现将nmol 2-甲基丁烷与适量溴蒸气在一定条件下完全反应,若只生成四种一溴代物和溴化氢,则
(1)反应中生成溴化氢的物质的量为 mol。
(2)将反应生成的四种一溴代物的混合气体充分燃烧,生成H2O,CO2和HBr,此时需消耗氧气 mol
(3)若上述溴的取代反应中,伯、仲、叔氢原子被溴原子取代的几率比为a:b:c,则生成的四种一溴代物中,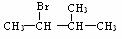 所占的物质的量分数为
。
所占的物质的量分数为
。
22.t℃将3molA和2molB气体通入固定体积为2L的密闭容器中,发生如下反应
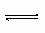
3A(g)+B(g) XC(g),2min时反应达平衡。(温度不变)剩余1.8molB,
并测得C的的浓度为0.4mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ,X= 。
(2).比较达到平衡时,A.B两反应物的转化率: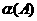
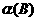 (填> = 或 < )
(填> = 或 < )
(3).若继续向原平衡混合物的容器中通入少量氩气(氩气和A.B.C均不反应)后,则平衡
(填“向左移动”“ 向右移动”“不移动”)
(4)在t℃时,若向原平衡混合物的容器中再充入amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入 (填A或B) mol(用a表示),达新平衡时,A的物质的量为n(A)= (用含a的式子表示)
21. A-I分别表示中学化学中常见的一些物质,它们之间相互关系如下图所示(部分反应物,生成物没有列出),已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: 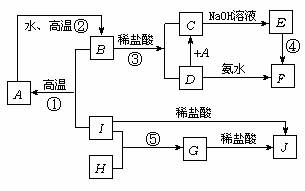
(1) A、B、C、D、E、F六种物质所含的同一种元素是:Fe;
(2) G、F的化学式分别是: 、
(3) 写出①②④反应的化学方程式:
①
②
④
(4) G与NaOH溶液反应的离子方程式:
(5) 在①②③④⑤反应中,属于放热反应的是:
20. 实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混有CO2、SO2等杂质。某同学设计了如下装置(气密性良好),通过使弹簧夹K1和K2打开或关闭控制气体流向,证明乙烯中混有CO2、SO2并验证乙烯的性质。
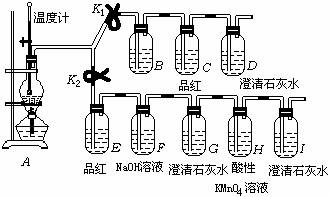
(1) 烧瓶中放入几块碎瓷片的作用是 ,图中一处明显错误是
(2) 若实验时看到G中澄清石灰水无明显现象但I中澄清石灰水混浊,请对出现该现象的原因提出一合理的猜想是:
(3) 说明混合气体中含有CO2的现象是 : 说明混合气体中含有乙烯的现象是:
(4) F中NaOH溶液的作用是:
B中应盛放的试剂是: (选填“溴水”或“酸性高锰酸钾溶液”)。
19.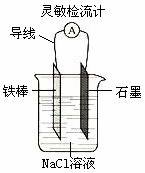 (1)下列有关实验的叙述正确的是(填序号)
(1)下列有关实验的叙述正确的是(填序号)
A.用酸式滴定管量取20.00mlKMnO4溶液
B. 蒸干并灼烧FeCl3溶液可得纯净的无水氯化铁;
C.用已知浓度的盐酸滴定未知浓度的氨水,选用酚酞用指示剂
D. 制Fe(OH)2时,盛NaOH溶液的滴管不能伸入到试管底部
E.为了使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用 铜丝网包裹的锌粒
F.如右图,可观察到灵敏检流计的指针偏转;
(2)有一瓶浅绿色的硫酸亚铁晶体,由于保存不善,又放置了较长时间,可能被氧化,试用实验证明它是部分被氧化,还是完全被氧化,并完成实验报告
实验目的:
实验步骤(1)取少量晶体溶于水,加稀硫酸酸化
(2)
(3)
结论:
18.物质的量浓度相同(0.1mol/L)的弱酸HX和NaX溶液等体积混合后,溶液中微粒浓度关系错误的是
A. C(HX)+C(X-)=C(Na+)=0.1mol/L B. C(Na+)+C(H+)=C(X-)+C(OH-)
C. 若溶液呈碱性,则C(Na+)> C(HX)> C(X-)>C(OH-)>C(H+)
D. 若溶液呈酸性,则C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-)
第Ⅱ卷(非选择题 共78分)
17.向某FeBr2溶液中,通入不1.12L (标准状况下)的Cl2,测得溶液中C(Br-)=3C(Cl-)=0.3mol/L(反应过程中溶液的体积变化及离子的水解不计)则下列说法中正确的是
A.原溶液的浓度为0.1mol/L B.反应后溶液中C(Fe3+)=0.1mol/L
C.原溶液中C(Br-)=0.4mol/L D. 反应后溶液中C(Fe3+)=2C(Fe2+)
16.  高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn - 2e- + 2OH- = Zn(OH)2
B.放电时正极反应为:Fe(OH)3 - 3e- + 5OH- = FeO42- + 4H2O
C.放电时每转移3moL电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com