
题目列表(包括答案和解析)
26. (8分) 向纯碱溶液中滴入酚酞溶液,观察到的现象是______________,原因是(用离子方程式表示)
______________________________________________________;若再向该溶液中滴入过量氯化钙溶液,观察到的现象是__________________________,原因是_______________________________________。
27 (8分).今有①CH3COOH、②HCl、③H2SO4 三种溶液,用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度的由大到小排列是 。
(2)当它们的物质的量浓度相同时,其pH的由大到小排列是 。
(3)中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为 。
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液pH为7,所需烧碱溶液的体积关系为 。
25.有5.1g镁、铝合金,投入500mL 2 mol/L盐酸溶液后,金属全部溶解后,再加入4 mol/L NaOH溶液,若要达到沉淀最大值,则加入NaOH溶液的体积应为( )
A.250mL B.425mL C.500mL D.560mL
(Ⅱ卷 50分)
24.根据酸碱质子理论:凡是能给出质子(即氢离子)的分子或离子都是酸;凡是能结合质子的分子或离子都是碱。按照此理论,下列粒子属于两性物质的是( )
A.NO2- B.HN03 C. H2PO4- D.NH4+
23.下列离子方程式中,正确的是( )
A.硫酸亚铁溶液与过氧化氢溶液混合 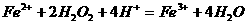
B.小苏打溶液与稀硫酸混合 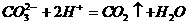
C.大理石溶解于醋酸 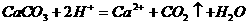
D.明矾溶液加热水解生成沉淀 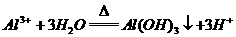
22.漂白粉溶液中存在下列平衡ClO-+H2O HClO+OH-下列措施不能提高其漂白效果的是( )
HClO+OH-下列措施不能提高其漂白效果的是( )
A.加入少量氢氧化钠 B.通入过量二氧化碳
C.加入适量稀盐酸 D.加少量冰醋酸
21.某原电池总反应的离子方程式为 2Fe3+ +Fe = 3Fe2+ ,可以实现上述反应的原电池是( )
|
|
正 极 |
负 极 |
电解质溶液 |
|
A |
C |
Cu |
Fe2(SO4)3 |
|
B |
Ag |
Fe |
FeCl3 |
|
C |
Cu |
Fe |
CuSO4 |
|
D |
Fe |
Zn |
Fe2(SO4)3 |
20. 95℃时,纯水中的 H+ 的物质的量浓度为1×10-6 mol·L-1 ,若把 0.01 mol NaOH固体溶解在95℃水中配成 1 L溶液,则溶液的 pH 为( )
A.2 B.4 C.10 D.12
19.用标准浓度的NaOH溶液来滴定未知浓度的盐酸,在下列操作中,会使盐酸测定浓度偏高的是( )
⑴碱式滴定管用蒸馏水洗净后未用标准溶液润洗
⑵锥形瓶中盛有少量蒸馏水,再加待测液
⑶移液管用蒸馏水洗净后,未用盐酸润洗
⑷滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑸滴定后观察滴定管读数时,视线高于刻度线
A.⑵⑶ B.⑴⑶ C.⑴⑷ D.⑷⑸
18.有等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
A. V3>V2>V1 B. V3=V2=V1 C. V3>V2=V1 D. V1=V2>V3
17.将物质的量相等的硫酸铝和硫酸铵溶水形成VmL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com