
题目列表(包括答案和解析)
21、我们用字母L、M、Q、P、R、X分别代表五种含不同化合价的氮元素的物质,并且每种物质中氮元素的化合价只有一种,又知道物质L中的氮元素的化合价要比物质M中氮元素的化合价低,并且在一定条件下,它们会有如下的相互转换关系(未配平)
Q + HCl → M +Cl2 R
+ L → X + H2O R + O2 → L + H2O
请判断:(1)已知这五种物质中有一种是硝酸,那么硝酸应该是L、M、Q、R、X中的_________(填字母),判断的依据是________________________________
___
(2)反应③是在催化剂(如铂、氧化铁等)存在,并且加热到一定温度下反应,这个反应在工业上有重要的作用,若物质X是密度比CO2小的气体,X的分子式是________
(3)某同学写出下面三个不同价态的氮的化合物相互转换的关系(未配平)、
A.NO+HNO3 → N2O3+H2O B.NH3+NO → HNO2+H2O
C.N2O4+H2O → HNO3+HNO2
其中一定不可能实现的是____(填编号)
22、已知硫化氢与甲烷一样可在空气中燃烧,当氧气足量时其燃烧产物之一为二氧化硫。下列转化关系中A是一种正盐,D的相对分子质量比C大16,E是酸。X无论是强酸(非氧化性酸)还是强碱时都有如下转化关系(其它产物及条件均已略去):
 当x是强酸(非氧化性酸)时,A、B、C、D、E均含有同一种元素;当x是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题:
(1)A是 ,Y是 ,Z是 (填化学名称)。
(2)当X是强酸时,B的摩尔质量为34g/mol,E是 (填化学式),C→D的化学方程式是
。
(3)当X是强碱时,E是
(填化学式),B→C的化学方程式是
。
23、有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保 持内外压强相等.在相同条件下将3molA,1molB分别同时混合于a、b两容器中,发生反应3A(g )+B(g)
当x是强酸(非氧化性酸)时,A、B、C、D、E均含有同一种元素;当x是强碱时,A、B、C、D、E均含有另一种元素。
回答下列问题:
(1)A是 ,Y是 ,Z是 (填化学名称)。
(2)当X是强酸时,B的摩尔质量为34g/mol,E是 (填化学式),C→D的化学方程式是
。
(3)当X是强碱时,E是
(填化学式),B→C的化学方程式是
。
23、有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保 持内外压强相等.在相同条件下将3molA,1molB分别同时混合于a、b两容器中,发生反应3A(g )+B(g)  2C(g)+D(g)
(1)达平衡时,a中A的浓度为M mol·L-1,C的浓度为N mol·L-1,b中A的浓度为m mol·L-1,C的浓度为n mol·L-1,则M m;N
n;(填>、<、=、无法比较)
(2)保持温度不变,按下列配比分别充入a、b两容器,达平衡后a中c的浓度为N mol·L- 1的是( ),b中c的浓度为n mol·L-1的是( )
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1molD
2C(g)+D(g)
(1)达平衡时,a中A的浓度为M mol·L-1,C的浓度为N mol·L-1,b中A的浓度为m mol·L-1,C的浓度为n mol·L-1,则M m;N
n;(填>、<、=、无法比较)
(2)保持温度不变,按下列配比分别充入a、b两容器,达平衡后a中c的浓度为N mol·L- 1的是( ),b中c的浓度为n mol·L-1的是( )
A.6molA+2molB B.3molA+2molC C.2molC+1molB+1molD
D.2molC+1molD E.1.5molA+0.5molB+1molC+0.5molD (3)若将2molC和2molD充入a中,保持温度不变,平衡时A的浓度为Wmol·L-1,C的浓 度为Ymol·L-1,则W和M,Y和N之间的关系为W M、Y N. (4)保持温度不变,若将4molC和2molD充入a中,平衡时A的浓度为Rmol·L-1则 ( ) A. R=2M B.R<M C.M<R<2M D.R>2M 四、计算 24、将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答: (1)NO,NO2的体积各为多少升? (2)待产生的气体全部释放后,向溶液加入V mLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为多少? (3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水的质量为多少?。
2、在日光的照射下,下列物质不发生化学变化的是
A、浓HNO3
B、H2和N2的混合气 C、溴化银 D、氯水
3、在一密闭烧瓶中,在25℃时存在着平衡:2NO2 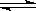 N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A ①和③ B ②和④ C ④和⑤ D ③和⑤
4、实验室存放下列药品的方法错误的是
A、少量白磷贮存在水中 B、水玻璃贮存在带玻璃塞的玻璃瓶中
C、液溴贮存在水中 D、浓硝酸贮存在棕色的细口玻璃瓶中
5、在一定条件下,反应A2(g)+B2(g)
N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A ①和③ B ②和④ C ④和⑤ D ③和⑤
4、实验室存放下列药品的方法错误的是
A、少量白磷贮存在水中 B、水玻璃贮存在带玻璃塞的玻璃瓶中
C、液溴贮存在水中 D、浓硝酸贮存在棕色的细口玻璃瓶中
5、在一定条件下,反应A2(g)+B2(g) 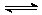 2AB(g)达到平衡状态的标志是
A.单位时间内生成n mol A2的同时,生成n mol的AB
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.单位时间内,生成n mol A2的同时,生成n mol的B2
6、标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂作喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为
A 2:1:2 B 5:5:4 C 1:1:1 D无法确定
7、有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107- 5×107Pa,因在该压强下铁触媒的活性最大
8、对已达化学平衡的下列反应:2X(g)+Y(g)
2AB(g)达到平衡状态的标志是
A.单位时间内生成n mol A2的同时,生成n mol的AB
B.容器内的总压强不随时间而变化
C.单位时间内生成2n mol AB的同时,生成n mol的B2
D.单位时间内,生成n mol A2的同时,生成n mol的B2
6、标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂作喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为
A 2:1:2 B 5:5:4 C 1:1:1 D无法确定
7、有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107- 5×107Pa,因在该压强下铁触媒的活性最大
8、对已达化学平衡的下列反应:2X(g)+Y(g) 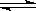 2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
9、在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:
CO(g)+H2O(g)
2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
9、在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:
CO(g)+H2O(g) 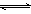 CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
A.等于0.6mol B.等于1mol C.大于1mol D.大于0.6mol,小于1mol
10、在密闭容器中进行如下反应:N2+3H2
CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是
A.等于0.6mol B.等于1mol C.大于1mol D.大于0.6mol,小于1mol
10、在密闭容器中进行如下反应:N2+3H2 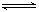 2NH3(正反应放热),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
(1)平衡不发生移动 (2)平衡沿着正反应方向移动(3)平衡沿着逆反应方向移动
2NH3(正反应放热),若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
(1)平衡不发生移动 (2)平衡沿着正反应方向移动(3)平衡沿着逆反应方向移动
(4)NH3的质量分数增加(5)正逆反应速率都增大
A.(1)(5) B.(1)(2)(5) C.(3)(5) D.(2)(4)(5)
11、含有硫酸铵和硝酸铵的混合溶液AL,加入amolNaOH,刚好使氨气全部逸出,加入bmolBaCl2,刚好使SO42-离子全部沉淀,则混合溶液中硝酸铵的物质的量浓度是
A、a/Amol/L
B、A/bmol/L
C、(a-2b)/A
mol/L D、(a-b)/A mol/L
12、某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入2.56克Cu粉,待充分反应后,溶液中Cu2+物质的量浓度为
A 0.15mol/L B 0.3mol/L C 0.225mol/L D 无法计算
二、选择题(每小题有1-2个正确答案)
13、下图表示的平衡混和物中,产物X的百分含量在不同压力下随温度改变的情况,在下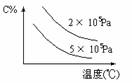 述哪一个可逆体系中X可代表用横线标明的物质
A N2(g)+O2(g)
述哪一个可逆体系中X可代表用横线标明的物质
A N2(g)+O2(g) 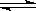 2NO(g)(正反应吸热)
B 2SO3(g)
2NO(g)(正反应吸热)
B 2SO3(g) 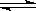 2SO2(g)+O2(g)(正反应吸热)
C N2(g)+3H2(g)
2SO2(g)+O2(g)(正反应吸热)
C N2(g)+3H2(g) 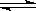 2NH3(g)(正反应放热)
D 4NH3(g)+3O2(g)
2NH3(g)(正反应放热)
D 4NH3(g)+3O2(g) 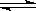 2N2(g)+6H2O(g)(正反应放热)
14、 0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
15、两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和O2各2 mol,加热到相同温度,有如下反应2SO2(g)+ O2(g)
2N2(g)+6H2O(g)(正反应放热)
14、 0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C.50 D.66
15、两个体积相同的密闭容器A、B,在A中充入SO2和O2各1mol,在B中充入SO2和O2各2 mol,加热到相同温度,有如下反应2SO2(g)+ O2(g) 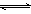 2SO3(g),对此反应,下述不正确的是
A.反应速率B>A B.SO2的转化率B>A
C.平衡时各组分含量B = A D.平衡时容器的压强B>A
16、已知碱能除去硝酸尾气:NO+NO2+2NaOH
2SO3(g),对此反应,下述不正确的是
A.反应速率B>A B.SO2的转化率B>A
C.平衡时各组分含量B = A D.平衡时容器的压强B>A
16、已知碱能除去硝酸尾气:NO+NO2+2NaOH
2NaNO2+H2O。根据硝酸尾气处理的反应原理,下列气体中不可能被过量的NaOH溶液吸收的
A.1molO2和4molNO2
B.1molNO和4molNO2
C.1molO2和4molNO
D.4molNO和1molNO2
17、氢叠氮酸HN3与氢卤酸相似,它是易挥发的弱酸,下列叙述中不正确的是
A 它的水溶液中存在着N3-离子 B 是无色、有刺激性气味的气体
C NaN3与稀硫酸作用生成HN3 D 它与氨作用生成的是共价化合物
18、某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是
A.Cl-、Mg2+、H+、Zn2+、SO42-
B.MnO4-、K+、Cl-、H+、SO42-
C.Na+、Ba2+、NO3-、HCO3-、SO42- D.K+、NO3-、SO42-、OH-、Na+
1、本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是 A.化学反应速率理论是研究怎样在一定时间内快出产品 B.化学平衡理论是研究怎样使用有限原料多出产品 C.化学反应速率理论是研究怎样提高原料转化率 D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
28. (12分)将Na2CO3和NaHCO3的混合物29.6g与足量的稀盐酸充分反应,结果生成气体6.72升(标准状况)。求混和物中Na2CO3和NaHCO3的质量分数。
27.(6分)下图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如下转化关系。(反应中生成的水已略去)
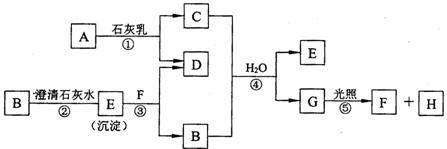
(1)E是_____________,F是_____________,H是_____________。(填化学式)
(2)C物质在日常生活中可作_____________________剂。
(3)写出反应①的化学方程式:____________________________
26、(3分)氢氧化钠和氢氧化铝是两种重要的化合物。请回答:
(1)由于钠的金属性比铝 ,因此氢氧化钠的碱性比氢氧化铝强。
(2)在氯化铝溶液中逐滴加入过量的氢氧化钠溶液,观察到的实验现象是 ________(填字母)。
a. 只放出气体 b. 产生白色沉淀,随后沉淀溶解
c. 只产生白色沉淀 d. 既产生白色沉淀,又放出无色气体
(3)写出氢氧化铝与氢氧化钠溶液反应的离子方程式: 。
25.(5分)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
(1)取少量待测液,仔细观察,呈无色;
(2)向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解。实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝。
据此可以判断该待测液中一定含有的阳离子是_______________,一定没有的阳离子是___________________。还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)_______________,现象是_______________________。
24.(5分)实验室欲配制80mL 2mol/L的KCl溶液,就配制该溶液的过程,请回答:
(1)不需要的仪器是 ;
A.烧杯 B.100mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F. 50mL容量瓶
(2)配制时应称取KCl g;
(3)下列操作的顺序是(用字母表示) ;
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(4)若容量瓶未干燥即用来配制溶液,实验结果将 ,若定容时俯视刻度线,实验结果将 。
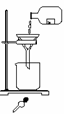
23.某学生发现滴瓶中溶液变浑浊,拟用右图所示操作进行过滤,错误的操作有
A.4处 B.3处 C.2处 D.1处
选择题答案填入下表:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
|
17 |
18 |
19 |
20 |
21 |
22 |
23 |
|
|
|
|
|
|
|
|
|
|
22、下列实验操作对所配溶液浓度无影响的是
A、砝码有残缺
B、转移或搅拌溶液时有部分液体溅出
 C、定容时水加多了,用滴管吸出
C、定容时水加多了,用滴管吸出
D、当药品,砝码左右位置颠倒时,未使用游码
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com