
题目列表(包括答案和解析)
4.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
3.下列过程中△H小于零的是
A. 氯酸钾分解制氧气 B. 氯化铵分解得氨气
C.碳酸钙分解得二氧化碳 D. 实验室制备氢气
2.下列说法中正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,
反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
14.(13分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入
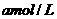 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的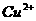 全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在 溶液中全部转化为
溶液中全部转化为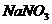 ,至少需要30%的双氧水多少g?(请写出完整的计算过程)
,至少需要30%的双氧水多少g?(请写出完整的计算过程)
13.(12分)下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:
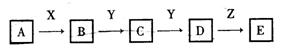
当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
(1)写出化学式:A是___________,Y是________,Z是_________。
(2)当X是强碱时,E是____________,当X是强酸时,E是__________。
(3)当X是强碱时,写出A与X反应的离子方程式:
_______________________________________________
12.(15分)如图甲和乙是有关硝酸和铜反应的实验装置示意图,试回答下列问题:
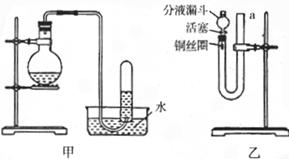
(1)写出制取NO气体时发生反应的离子方程式: 。
(2)某同学用甲装置进行实验,通过排水法收集到无色气体,证明稀HNO3与Cu反应生成的气体是NO,是否可行? ,原因是
。
(3)有人设计了装置乙进行实验,证明稀硝酸与Cu反应生成NO气体。请将下列有关操作补充安全:将活塞打开,从U形管的长管口a注入稀硝酸至 为止,关闭活塞,用酒精灯在 处微热,当U形管左侧产生气泡时,立即撤去酒精灯。
(4)用装置乙进行实验时,一段时间后反应可自动停止,原因是
。
(5)用装置乙进行实验时,如何证明生成的无色气体是NO?
。
11.(8分)碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,氢化钠具有较强的还原性。
(1)氢化钠的电子式为____________,氢化钠中氢元素是______价。
(2)NaH能与水剧烈反应生成对应的碱和氢气,写出反应的化学方程式并标明电子转移的方向和数目_______ ____。该反应中氧化产物与还原产物的质量比为______________。
10.随着人们生活水平的提高,小汽车已进入平常百姓家。为了保护行驶人员的安全,常备有防撞气囊,内装有能在撞车后10ms(1ms=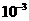 s)内发生爆炸性反应的物质
s)内发生爆炸性反应的物质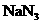 ,化学方程式为
,化学方程式为 ,驾驶员可在汽车遭撞击后受气囊保护而脱险。此外,气囊内还装有陶土、
,驾驶员可在汽车遭撞击后受气囊保护而脱险。此外,气囊内还装有陶土、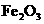 粉等物质,以使气囊内产生的
粉等物质,以使气囊内产生的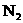 在100ms-200ms内消失,同时气囊内的Na变为
在100ms-200ms内消失,同时气囊内的Na变为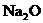 。下列说法中不正确的是 ( )
。下列说法中不正确的是 ( )
A.在1mol -离子中共含有16mol电子
-离子中共含有16mol电子
B.配方中,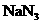 与
与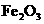 的物质的量之比应在3∶1左右
的物质的量之比应在3∶1左右
C.气囊内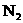 迅速消失的目的是在撞车时不致使人反弹
迅速消失的目的是在撞车时不致使人反弹
D.气囊的保护作用是通过延长作用时间实现的
班级 学号 姓名
9.将2.6g某金属与足量稀硝酸充分反应无气体放出,再向溶液中加入过量NaOH溶液并加热,收集到标况下气体0.224L,该金属是 ( )
A.Zn B.Fe C.A1 D.Mg
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com