
题目列表(包括答案和解析)
14.(10分)已知2H2(g)+ O2(g)===2H2O(l) ΔH = -571.6 kJ· mol-1
CO(g) + 1/2O2(g) == CO2(g) △H = -283 kJ· mol-1
某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,求原混合气体中H2和CO的物质的量。
13.(13分)某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺,因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量。”(已知煤炭的燃烧热为-393.15 kJ/mol,氢气的燃烧热为-242 kJ/mol,一氧化碳的燃烧热为-283 kJ/mol)
(1)写出该同学看到燃烧现象所涉及到的所有热化学反应方程式;
;
你认为该同学的结论是否正确,请简要说明理由。
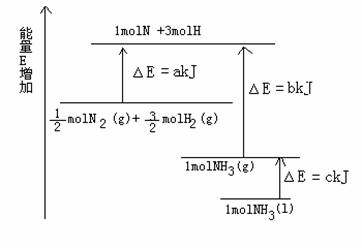
12.(15分)已知化学反应N2+3H2=2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是--------------------------------能量的过程(填“吸收”或“释放”)。
(2)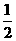 N2(g)+
N2(g)+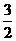 H2(g)=NH3(g);
H2(g)=NH3(g);
△H= ;
(3)N2(g)和H2生成NH3(1)的热化学方程式为------------------------------------------------------
11。(12分)实验室利用右图装置进行中和热的测定,请回答下列问题:
(1)在操作正确的前提下,提高中和热测定准确性的关键是
(2)做1次完整的中和热测定实验,温度计需使用 次,
某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别
测量酸和碱的温度,你是否同意该同学的观点,为什么?
(3)请为本实验设计数据记录表格:
10.一些盐的结晶水合物,在温度不太高时就有熔化现象,即熔溶于自身的洁净水中,又同时吸收热量。他们在塑料袋中经日晒就熔化,又在日落后缓慢凝结而释放热量。故可用于调节室内温度,或用作夏日防暑的枕垫或坐垫,这些物质可称之为热材料。现有几种盐的结晶水合物有关数据如下:
|
|
① Na2S2O3·5H2O |
②CaCl2·6H2O |
③Na2SO4·10H2O |
④ Na2HPO4·10H2O |
|
熔点/℃ |
40-50 |
29.92 |
32.38 |
35.1 |
|
熔化热/kJ· mol-1 |
49.7 |
37.3 |
77 |
100.1 |
根据上述数据和实用性考虑,实际运用时常采用的物质应该是
A.① B.② C.③ D.④
高二 班 姓名 学号 成绩
9.下列说法或表示法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)→C(金刚石) ΔH = +119 kJ·mol-1可知,石墨比金刚石稳定
C.在稀溶液中:H++OH-===H2O ΔH = -57.3 kJ· mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)===2H2O(l) ΔH = +285.8 kJ· mol-1
8.以NA代表阿伏加德罗常数,则关于热化学方程式 C2H2 ( g ) +5/2O2 ( g ) →2CO2 ( g )+H2O ( l ) △H = -1300kJ / mol 的说法中,正确的是
A. 当10 NA个电子转移时,该反应放出1300kJ的能量
B. 当1 NA个水分子生成且为液体时,吸收1300kJ的能量
C. 当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D. 当8 NA个碳氧共用电子对生成时,放出1300kJ的能量
7.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A. 该反应是吸热反应 B. 该反应是放热反应
C. 铁粉和硫粉在常温下难以发生反应 D. 硫化亚铁的总能量高于铁粉和硫粉的总能量
6.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H
=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀
硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
A.△H1>△H2>△H3 B.△H1<△H2<△H3
C.△H1>△H2=△H3 D.△H1=△H2<△H3
5.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中反应热最小的是
A.2A ( l ) + B ( l ) = 2C (g ) △H1 B.2A ( g ) + B ( g ) = 2C (g ) △H2
C.2A ( g ) + B ( g ) = 2C ( l ) △H3 D.2A ( l ) + B ( l ) = 2C ( l ) △H4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com