
题目列表(包括答案和解析)
3.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( ) A.植物油不能使溴的四氯化碳溶液褪色
B.蔗糖水解可以得到等质量的两种产物
C.葡萄糖能发生氧化反应和水解反应
D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
2.生活中的一些问题常涉及化学知识,下列叙述正确的是 ( )
A.蚕丝、棉花和人造丝的主要成分都是纤维素
B.苯酚不小心沾到皮肤上,应立即用氢氧化钠稀溶液洗涤
C.酒厂可用工业酒精勾兑白酒
D.福尔马林是一种良好的杀菌剂,但是不能用来消毒饮用水
1.2002年诺贝尔化学奖授予利用“质谱分析法”和“核磁共振技术”等对生物大分子进行
研究并作出重大贡献的科学家。下列物质中属于生物大分子的是 ( )
A.油脂 B.葡萄糖 C.氨基酸 D.蛋白质
24.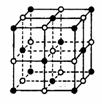 (10分)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。NaCl晶体结构如图所示, 食盐晶体是由钠离子(图中的“●”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度ρ为5.71g/cm3,晶胞边长为4.28×10-10m。(铁相对原子质量为55.9,氧相对原子质量为16)求:
(10分)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。NaCl晶体结构如图所示, 食盐晶体是由钠离子(图中的“●”)和氯离子(图中的“○”)组成的,且均为等距离的交错排列。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度ρ为5.71g/cm3,晶胞边长为4.28×10-10m。(铁相对原子质量为55.9,氧相对原子质量为16)求:
(1)在1molFexO晶胞中含__________molFexO; FexO中x值(精确至0.01)为_____________。
(2)FexO晶体中Fe元素的离子间(Fe离子与Fe离子)最近距离r=________________m (3)写出铁原子的电子排布式_________________________,并分析:铁元素为什么会出现Fe2+和Fe3+,且Fe3+价稳定?_______________________________________
23.(10分)A、B、C、D、E是短周期的五种主族元素。A元素的某种原子,其核内没有中子;B元素的基态原子2p轨道上只有一对成对电子;C与B处于同一周期,且原子半径小于B;D与C是同主族元素;E元素的一价阳离子和C元素的阴离子具有相同的电子层结构。根据上述信息回答下列问题:
(1)B元素的原子结构示意图是 ;C元素原子的轨道表示式是 ;D元素原子的外围电子排布式是 ;A2B2的电子式是 。
(2)A元素分别与C、D两元素形成的化合物的稳定性由强到弱的顺序是(用化学式表示) ;
(3)由B、D、E三种元素组成的某种化合物的水溶液能使pH试纸先变蓝后褪色,写出该化合物的化学式 ;用一个离子方程式表明该化合物水溶液使pH试纸先变蓝后褪色的原因 。
并写出产物中能使pH试纸褪色的物质的电子式_
22.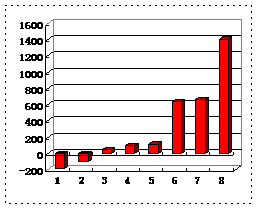 (6分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(6分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。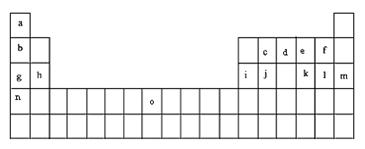
试回答下列问题
(1)元素“O”在周期表中的位置是 。
 (2)画出“c”的简化电子排布式
。
(2)画出“c”的简化电子排布式
。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母,下同),“7”代表 。
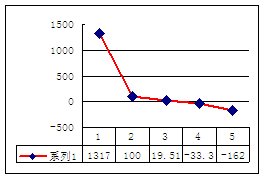
(4)b、c、d、e、f的氢化物的沸点(℃);直角坐
标图如右,序列“5”氢化物(注:碱金属的氢化物为离子化合物)的化学式为:
;序列“1”氢化物的电子式为: 。
21.(8分)C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构):
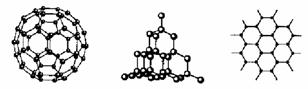
(1)C60、金刚石和石墨三者互为_____________。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)金刚石晶体结构中,平均每个最小六元环(不在同一平面上)占有的碳原子数是_________。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是_______NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是_______。
(4)金刚石对比C60固体熔点更高的原因是____________________ __________。
(5)解释:金刚石不能导电,石墨具有导电性的原因是_____________________.
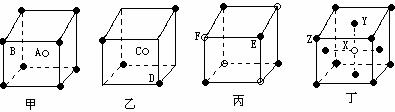
20.(4分)现有甲、乙、丙、丁四种晶胞(如图所示),可推知:甲晶体中每个B离子周围结合A离子的个数为 ;乙晶体的化学式为 ;丙晶体的化学式为___ ___;丁晶体的化学式为____ __。
19.(4分)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于
周期 族;最高价氧化物的化学式为 ,砷酸钠的化学式是 。
18.(7分)有下列8种晶体,用序号回答下列问题:
A.水晶 B.冰醋酸 C.白磷 D.固态氩 E.氯化铵 F.铝 G.金刚石
(1)属于原子晶体的化合物是 ,
(2)含极性键的分子晶体是 ,含有共价键的离子晶体是 ,属于分子晶体但不含化学键的单质是 .
(3) 在一定条件下能导电而不发生化学反应的是 ,分子内存在化学键,但受热熔化时,化学键不发生变化的是 ,受热熔化,需克服共价键的是 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com