
题目列表(包括答案和解析)
30.(12分) 化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。
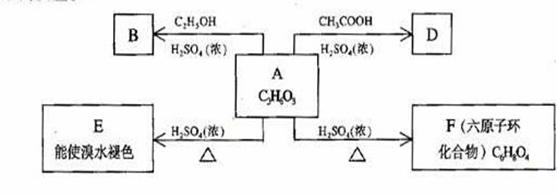
试写出:
化合物的结构简式:A___________________ B_________________
D___________________
化学方程式:A→E_____________________________________
A→F____________________________________
反应类型:A→ E______________,A→F_______________
29.(12分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:___________< X <___________。
② 根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_______________________________________________________________________________; 简述元素电负性X的大小与元素金属性、非金属性之间的关系_________________________________________________________________________________________。
③ 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是_________________________________________________________________________________________________________。
自从1869年俄国化学家门捷列夫将当时已发现的63种元素列成元素周期表后,许多科学家一直致力于元素周期律和周期表的研究。元素周期表揭示了元素之间的内在联系,反映了元素性质与它的原子结构的关系,在哲学、自然科学、生产实践各方面都有重要意义。请完成以下关于元素周期表的题目。
28.(8分) 下面是元素周期表的简略框架图。
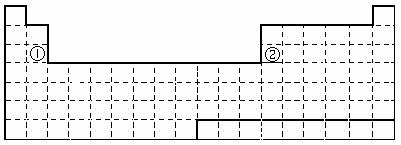
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
按原子核外电子排布,可把元素划分成5个区,不全是金属元素的区为__________。
(2)上表中元素①、②原子的价电子排布式分别为 、 ;
比较元素①与元素②的下列性质(填写“>”或“<”=)
原子半径:①_______②、电负性:①______②、金属性:①______②。
⑶某短周期元素最高正价为+7,其原子结构示意图为_____________。
27.(9分) A、B、C三种短周期元素,原子序数依次增大,三种元素数依次之和为35,A、C同族,B+离子核外有10个电子,回答下列问题
①. A、B、C三种元素分别是_________ 、 _________ 、_________。
②. A、B、C之间形成多种化合物,其中属于离子化合物的化学式分别为_________ 、 __________ 、___________。
③分别写出下列微粒的电子排列式:
A._______________________________________
B._______________________________________
C2-._______________________________________
26.(8分)有原子序数小于20的A、B、C、D、E、F六种元素,它们的原子序数依次增大,其中B元素是地壳中含量最多的元素。已知A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B、D两元素原子核内质子数之和的二分之一;C、D、E三种元素的基态原子具有相同的能层数,且E原子的p能级上电子数比D原子的p能级上多一个电子;六种元素的基态原子中,F原子的电子层数最多且和A处在同一主族。回答下列问题:
(1)用电子式表示C和E形成化合物的过程 ;
(2)写出基态F原子的核外电子排布式 ;
(3)用电子式写出A原子与D原子形成A2D分子过程
;
(4)写出E单质与A2B化合物反应的方程式 。
25.(10分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
⑴A在元素周期表中的位置_______________。
⑵A、B、C三种元素形成的简单离子的半径由大到小的顺序是______________。(填写离子符号)
⑶CA2与D元素的单质在水溶液中反应的离子方程式是:
。
⑷C元素常见的化合价有-2、+2、+4、+6等,C与A、B、D均能两两形成各原子(或离子)都满足最外层8电子稳定结构的化合物,请你大胆猜想,写出其中两种化合物的化学式__________、__________。
24.(6分)某元素的激发态(不稳定状态)原子的电子排布式为1s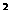 2s
2s 2p
2p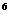 3s
3s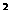 3p
3p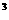 4s
4s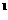 ,则该元素基态原子的电子排布式为
;元素符号为
;其最高价氧化物对应的水化物的化学式是
。
,则该元素基态原子的电子排布式为
;元素符号为
;其最高价氧化物对应的水化物的化学式是
。
23.(8分)有①NH2-CH2-COOH ②CH2OH(CHOH)4CHO ③(C6H10O5)n(纤维素)④HCOOC2H5 ⑤苯酚 ⑥HCHO等物质,其中(用数字序号填空):
(1)难溶于水的是_______,易溶于水的是________;
(2)能发生银镜反应的是_______ ;
(3)能发生酯化反应的是____________
(4)能跟氢气发生加成反应的是_______,能在一定条件下跟水反应的是______;
(5)能跟盐酸反应的是______,能跟氢氧化钠溶液反应的是________。
22.(5分)淀粉水解生成葡萄糖的反应的化学方程式为:____________________________,为证明淀粉已开始转化为葡萄糖,可加入___________________________进行检验;为证明淀粉已完全水解,可加入_______,现象是不显______。
21.(3分)液态的植物油经过________可以生成硬化油,天然油脂大多由______ _组成,油脂在________条件下水解发生皂化反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com