
题目列表(包括答案和解析)
7.对可逆反应4NH3(g) + 5O2(g) 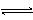 4NO(g)
+ 6H2O(g),下列叙述正确的是
4NO(g)
+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
6.下列实验操作完全正确的是
|
编号 |
实验 |
操作 |
|
A |
钠与水反应 |
用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
|
B |
配制一定浓度的氯化钾溶液1000mL |
准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
|
C |
排除碱式滴定管尖嘴部分的气泡 |
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
|
D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
5.
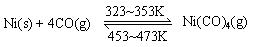 下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应:
但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,右端的主要物质是
A.纯Ni(s)和Ni(CO)4(g) B.纯Ni(s)和CO(g)
C.不纯Ni(s)和CO(g) D.不纯Ni(s)和Ni(CO)4(g)
4.有五瓶溶液分别是:①10mL0.60mol·L-1NaOH水溶液,②20 mL mol·L-1 H2SO4水溶液,③30 mL 0.40 mol·L-1HCl水溶液,④40 mL 0.30mol·L-1CH3COOH水溶液,⑤50mL0.20mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
3.取相同体积、相同pH的CH3COOH和HCl溶液,分别用等体积、等物质的量浓度的烧碱溶液与之作用,已知其中一种酸与NaOH恰好完全中和。若所得溶液的pH分别为pH1和pH2,则关于两者的比较正确的是
A.pH1>pH2 B.pH1<pH2 C.pH1=pH2 D.无法比较
2.用0.01mol/L NaOH溶液完全中和pH=3的下列溶液各100mL。需NaOH溶液体积最大的是
A.盐酸 B.硫酸 C.高氯酸 D.醋酸
1.某反应吸热(ΔH>0),在常温下能自发进行,则该反应的ΔS
A.可能大于0 B.可能小于0 C.肯定大于0 D.肯定小于0
22、(8分)某研究性学习小组欲探究原电池的形成条件,按右图所示装置进行实验并得到下表实验结果:
|
实验 序号 |
A |
B |
烧杯中的液体 |
 灵敏电流计指 灵敏电流计指针是否偏转 |
|
1 |
Zn |
Zn |
乙醇 |
无 |
|
2 |
Zn |
Cu |
稀硫酸 |
有 |
|
3 |
Zn |
Zn |
稀硫酸 |
无 |
|
4 |
Zn |
Cu |
苯 |
无 |
|
5 |
Cu |
C |
氯化钠溶液 |
有 |
|
6 |
Mg |
Al |
氢氧化钠溶液 |
有 |
分析上述数据,回答下列问题:
(1)实验2中电流由 极流向 极(填“A”或“B”)
(2)实验6中电子由B极 流向A极 ,表明负极是 电极(填“镁”或“铝”)
(3)实验5 表明
A.铜在潮湿空气中不会被腐蚀 B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是
A.相对活泼的金属一定做负极
B.失去电子的电极是负极
C.烧杯中的液体,必须是电解质溶液
D.浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种非金属)
21、(6分)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+2H2SO4
 2PbSO4+2H2O请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O请回答下列问题(不考虑氢、氧的氧化还原):
⑴放电时:负极的电极反应式是 ;
(2)充电时:电解液中H2SO4的浓度将变 ;
(3)在放电时,该电池的正极材料是 。
20、(8分)把煤作为燃料可通过下列两种途径:
途径I: C(s)+O2(g) === CO2(g)
途径II:先制水煤气: C(s) + H2O(g) === CO(g) + H2(g)
燃烧水煤气:2 CO(g) + O2(g) === 2CO2(g);
2H2(g)+O2(g) ===2H2O(g)
已知:①C(s)+O2(g)===CO2(g);△H1=-393.5 kJ·mol-1
②H2(g)+ O2(g)=H2O(g);△H2=-241.8kJ·mol-1
O2(g)=H2O(g);△H2=-241.8kJ·mol-1
③CO(g)+  O2 (g)
=CO2(g);△H3=-283.0kJ·mol-1
O2 (g)
=CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C的标准燃烧热是 kJ·mol-1
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量
(4)根据两种途径,下列说法错误的是
A.途径II制水煤气时增加能耗,故途径II的做法不可取
B.与途径I相比,途径II可以减少对环境的污染
C.与途径I相比,途径II可以提高煤的燃烧效率
D.将煤转化为水煤气后,便于通过管道进行运输
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com