
题目列表(包括答案和解析)
20.[答案]⑴放热 需要 E2-E1 ⑵409.0 kJ/mol ⑶虚线(Ⅱ)表示反应中使用了催化剂
19.[答案]⑴N2(g)+3H2(g) 2NH3(g)
ΔH=-90.8
kJ·mol-1 (3分)
2NH3(g)
ΔH=-90.8
kJ·mol-1 (3分)
⑵若反应进行到底,则H2过量、N2全部消耗,放热9.08 kJ,实际放热2.27 kJ,N2的转化率为25%(3分)
消耗H2
0.075 mol,v(H2)= =0.0075 mol/(L·min) (2分)
=0.0075 mol/(L·min) (2分)
18.[答案]⑴甲 当看到加入1滴KMnO4溶液,锥形瓶中溶液立即变成紫红色,且半分钟内不褪色,即达到滴定终点 ⑵否 因为不知道容量瓶的规格 ⑶BC (每空2分)
[说明]注意“滴定终点颜色变化”与“滴定终点如何判断”的差别。
17.[答案]⑴浓度和催化剂 ③②① ⑵温度 KMnO4溶液过量 (每空2分)
23.硫酸和盐酸混合溶液20mL,加入0.05mol/L的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液pH发生右图所示的变化。
⑴开始时混合溶液中硫酸和盐酸的物质的量浓度各是多少?
⑵在A点溶液的pH是多少?

1-5:C、D、B、D、B 6-10:C、D、B、AD、D 11-16:AB、C、CD、C、AB、BD
22.在一固定容积的密闭容器中,保持一定温度,在一定条件下进行反应:
A(g)+2B(g)
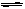 3C(g),已知加入1molA和3molB且达平衡后生成a molC,问:
3C(g),已知加入1molA和3molB且达平衡后生成a molC,问:
⑴ 平衡时C在反应混合气体中的体积分数是_______(用字母a表示);
⑵ 在相同实验条件下,若在同一容器中改为加入2molA和6molB,达平衡后,C的物质的量为 mol(用字母a表示)。此时C在反应混合气中的体积分数 (填增大、减少或不变)。
⑶ 在相同实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合气中的体积分数不变,则还应加入C_____mol。
⑷ 在同一容器中加入n molA和3n molB,在平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m之间变化,那么n与m的关系应是 (用字母m、n表示)。
21.Ⅰ:已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol·L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
(1)H5IO6是 (填“强电解质”或“弱电解质”)
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂是 (填化学式),反应的离子方程式为 __________________________________。
Ⅱ:NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______。(填序号)
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______。(填序号)
Ⅲ:25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白:
⑴a值可否等于3(填“可”或“否”)_________,其理由是___________________;
⑵a值可否等于5(填“可”或“否”)________,其理由是____________________;
⑶a的取值范围是_______________________________。
20.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。
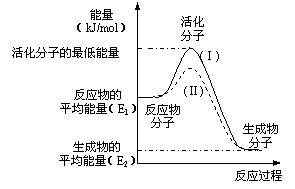
⑴图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的ΔH是_______________(用E1、E2表示)。
⑵已知热化学方程式:H2(g)+1/2 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为_________________。
⑶对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子数百分数增多,反应速率加快,你认为最可能的原因是________________________。
19.已知几种共价键的键能数据如下:
|
共价键 |
N≡N |
H-H |
N-H |
|
键能/(kJ·mol-1) |
946 |
436 |
390.8 |
⑴通过计算,写出合成氨反应的热化学方程式: 。
⑵某温度下,以0.1 mol N2和0.4 mol H2作为初始反应物,在体积为2 L的恒容密闭容器中进行合成氨反应,5 min后测得反应放热2 270 J,试计算N2的转化率 和H2的化学反应速率分别为 、 。
18. (10分)已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
(10分)已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。试回答下列问题:
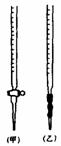
⑴0.0200mol·L-1KMnO4标准溶液应置于 (选填“甲”或“乙”)滴定管中;滴定终点如何判断 。
⑵你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”)。若回答“能”,请给出计算结果 ;若回答“否”,试说明原因 。
⑶若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
B.滴定前尖嘴部分有一气泡,滴定终点时消失
C.定容时,俯视刻度线
D.滴定前仰视读数,滴定后俯视读数
E.锥形瓶水洗之后未用待测液润洗
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com