
题目列表(包括答案和解析)
23.( 5分)用8.7gMnO2固体与4mol/L盐酸的300 mL充分反应后,能生成标准状况下的氯气多少升?所得溶液与足量的AgNO3作用生成沉淀的物质的量是多少?
第I卷答题栏(选择题,共48分)
22.( 6分)在一支10 mL的试管里充满NO2和O2,倒立于充满水的水槽中充分反应;
(1)若原混合气体中含NO2 2 mL,最后试管内剩余气体为___________mL;
(2)若原混合气体中含NO2 9 mL,最后试管内剩余气体为___________mL;
(3)现以y表示反应后试管内剩余气体的体积,x表示原混合气体中NO2的体积。
当0≤x≤8时,y=________________。
21、(12分)已知氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题:
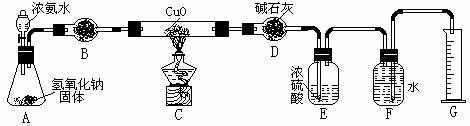
(1)写出氨气与氧化铜反应的化学方程式 。
(2)在A的锥形瓶中放入NaOH固体的目的是
。
(3)在干燥管B里不能选用的干燥剂是(填序号) 。
A. 碱石灰 B. 生右灰 C. 五氧化二磷 D. 氢氧化钠
(4)在C的玻璃管中观察到的现象是 。
(5)E装置中盛装浓硫酸的目的是 。
(6)待实验完毕后,若实验测得N2的体积为aL(已折算成标准状况),则被还原的氧化铜的物质的量为 mol(用含a字母的代数式表示);若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为(用含a、b字母的代数式表示) 。
(7)上述实验中,如果省去B装置,测定氨分子组成的N、H原子个数的比值将会(填“增大”、“减小”或“无影响”) ,理由是
。
20、(6分)有一混合气体,可能含有下列气体中的某几种:NH3、O2、NO、Cl2、HCl,在温度和压强不变的情况下进行如下实验,写出每步可以肯定的结论:
|
实 验 现 象 |
可 以 肯 定 的 结 论 |
|
A、观察混合气体无色 |
|
|
B、将混合气体通过浓H2SO4,体积减小 |
|
|
C、剩余气体跟空气接触后变为红棕色 |
|
19.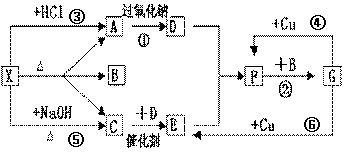 (10分)下图中的每一个方格中的字母表示有关的一种反应物或生成物,其中A、C为无色气体,C能使湿润的红色石蕊试纸变蓝。已知X不与氯化钡反应,请填写下列空白:
(10分)下图中的每一个方格中的字母表示有关的一种反应物或生成物,其中A、C为无色气体,C能使湿润的红色石蕊试纸变蓝。已知X不与氯化钡反应,请填写下列空白:
⑴化学式:X ,
C ,F ,
G 。
⑵反应④的离子方程式是:
;
⑶C和D反应的化学方程式:
⑷反应⑤的化学方程式
17 (共15分)
A、(8分)用双线桥表示下列反应中得失电子的情况,该反应的氧化剂 、氧化产物 、该反应中被还原的HNO3与未被还原的HNO3的质量之比为 。
3FeO + 10HNO3 == 3Fe(NO3)3 + NO↑ + 5H2O.
B、(3分)配平:
( )CrI3 +( )Cl2 + _____ -- ( )K2CrO4+( )KIO4+( )KCl+( )H2O
C、(4分)已知下列变化过程中,0.2molRxO42-参加反应时,共转移0.4mol电子。
RxO42- + MnO4- + H+ - RO2 + Mn2+ + H2O(未配平)
则x值为_________, 参加反应的H+ 的物质的量为_________mol。
18.(6分)三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术创新必不可少的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。则:
(1)氨的空间构型是________ ,
上述反应中,氧化剂与还原剂的物质的量之比为_________;若反应中有0.5 mol NH3 被氧化,转移电子的数目为 。
(2)在潮湿的空气中,NF3 能与水蒸气发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,则在NF3、F2 、NO三种气体中,氧化性由弱到强的顺序为 。
(3)一旦NF3 在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 。
16.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与0.84 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入3 mol•L-1 NaOH溶液至Cu2+ 恰好完全沉淀,则消耗NaOH溶液的体积是
A.30mL B.45mL C.50mL D.60mL
 重庆市垫江师范2008 年秋期高二化学月考题
重庆市垫江师范2008 年秋期高二化学月考题
高二年级化学试卷成绩统计表(考生不要填写)
第Ⅱ卷(非选择题 共60分)
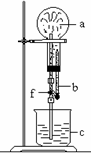
15.右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种
溶液。挤压胶管的胶头,下列与试验事实不相符的是
A.CO2(NaHCO3溶液) 无色喷泉 B.NH3(H2O含酚酞) 红色喷泉
C.H2S(CuSO4溶液) 黑色喷泉 D.HCl(AgNO3溶液) 白色喷泉
14. 下列各组离子可以大量共存的是( )。
下列各组离子可以大量共存的是( )。
(A) H+、K+、Fe2+、NO3–
(B) OH–、Na+、Cl–、NH4+
(C) Mg2+、Cl–、K+、NO3–
(D) Ag+、NO3–、Na+、S2–
)
13.在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别是0.4mol·L-1、0.1mol·L-1。向该混合液中加入1.92g铜粉,加热,等充分反应后,所得溶液中的Cu2+的物质的量浓度(mol·L-1)是( )
A.0.15 B.0.225 C.0.35 D. 0.45
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com