
题目列表(包括答案和解析)
24、(6分)向碳酸钠的浓溶液中逐滴加入稀盐酸,到不再产生二氧化碳气体为止。则在
此过程中,溶液中的碳酸氢根离子浓度的变化趋势可能是 (从下面的
选项中选择),
A.逐渐减少 B.逐渐增大
C.先逐渐增大,而后减小 D.先逐渐减小,而后增大
有关反应的离子方程式为 。
23、(15分)为测定冰醋酸在加水稀释的过程中溶液导电能力的变化,某学生用下图所示仪器设计了一个实验。
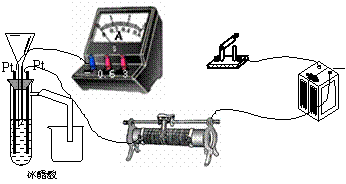 (1)请将下面所示仪器间没有连接的部分用导线连接起来完成本实验。
(1)请将下面所示仪器间没有连接的部分用导线连接起来完成本实验。
(2)电路开关闭合为t0时刻,之后向长颈漏斗中持续加入蒸馏水,并分别在t1、t2、t3时刻观察到电流计指针的偏转情况如下(其中t1<t2<t3,且在实验全过程中,t2时刻电流计指针偏转为最大)
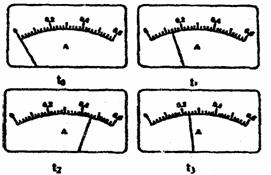 请据此信息分析,在t1到t2的过程中,溶液中[H+](填“增大”“减小”或“不变”)__________;继续加水,在t2到t3的过程中,溶液中[H+](填“增大”“减小”或“不变”)___________;请用简要文字解释冰醋酸在稀释过程中[H+]变化的原因_____________
请据此信息分析,在t1到t2的过程中,溶液中[H+](填“增大”“减小”或“不变”)__________;继续加水,在t2到t3的过程中,溶液中[H+](填“增大”“减小”或“不变”)___________;请用简要文字解释冰醋酸在稀释过程中[H+]变化的原因_____________
__________________________________________________________________________。
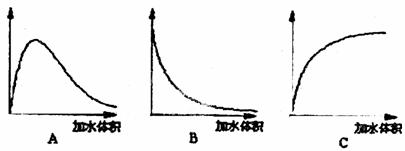
(3)下图中横坐标均表示向一定量冰醋酸中加入水的体积,请判断图中纵坐标的意义并填空。
纵坐标表示(请填选项字母):醋酸的电离度______________;醋酸的浓度__________;溶液的导电能力__________。
22、设NA为阿伏加德罗常数,下列说法正确的是
A.1L0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个
B.1L0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个
C.2L0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个
D.0.1mol/L的H3PO4溶液中,[H+]∶[PO43-]<3∶1
21、在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离度增大,H+ 浓度减小,可采用
的方法是
A.加热 B.加入0.1mol/L 的醋酸溶液100mL
C.加入少量的0.5mol/L的硫酸 D.加入少量的1mol/L 的NaOH溶液
20、在CH3COOH
 H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
H++CH3COO-的电离平衡中,要使电离平衡右移且氢离子浓
度增大,应采取的措施是 ( )
A.加入NaOH B.加入盐酸 C.加水 D.升高温度
19、.在同体积0.3 mol·L-1的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量的Zn,
下列说法中正确的是 ( )
A.硫酸中放出氢气量最多 B.醋酸中放出氢气量最多
C.盐酸中放出的氢气量最多 D.盐酸和硝酸中放出的氢气相等
18、有五瓶溶液分别是①10mL0.60mol·L-1NaOH水溶液,②20mL0.50mol·L-1H2SO4
水溶液,③30mL0.40mol·L-1HCl水溶液,④40 mL 0.30 mol·L-1CH3COOH水溶液,
⑤50 mL 0.20 mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序
是 ( )
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
17、下列各式中,属于正确的电离方程式的是 ( )
A.HCO3-
+ H2O 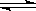 H2CO3 + OH-
B. HCO3- +OH- ==== H2O + CO32-
H2CO3 + OH-
B. HCO3- +OH- ==== H2O + CO32-
C.NH3
+ H+ === NH4+ D.NH3·H2O
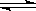 NH4+ + OH-
NH4+ + OH-
16、1 mol 下列物质,在水中能电离出3 mol 离子的是 ( )
A.H2S B.Fe2(SO4)3 C.Ba(OH)2 D.NaCl
15、电解质溶液导电能力的强弱决定于( A )
A.溶液中离子的浓度 B.溶液的浓度
C.溶液的体积 D.电解质本身的化学性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com