
题目列表(包括答案和解析)
7、用蒸馏水稀释1 mol·L-1醋酸时,始终保持增大趋势的是 ( )
A.溶液中的c(CH3COO-) B.溶液中的c(H+).
C.溶液中的c(CH3COOH).D.溶液中的c(OH-)
6、常温下c(OH-)最小的是 ( )
A.pH=0的溶液. B.0.05 mol·L-1 H2SO4.
C.0.5 mol·L-1 HCl. D.0.05 mol·L-1的Ba(OH)2
5、下列酸溶液的pH相同时,其物质的量浓度最小的是 ( )
A.H2SO3 B.H2SO4.C.CH3COOH D.HNO3.
4、能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是 ( )
A.向水中投入一小块金属钠 .B.将水加热煮沸.
C.向水中通入二氧化碳气体. D.向水中加食盐晶体
3、90℃时水的离子积KW=3.8×10-13,该温度时纯水的pH ( )
A.等于7 B.介于6-7之间. C.大于7 D.无法确定
2、常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是 ( )
A.1×10-14 B.1×10-13.
C.1.32×10-14 D.1.32×10-15.
1、下列液体pH>7的是 ( )
A.人体血液 B.蔗糖溶液 C.橙汁 D.胃液
25.完全燃烧某烃A,并收集产生的全部水蒸气,恢复至室温时,测得水的质量正好等于该烃的质量,按要求回答下列问题:
(1)该烃的最简式是 。
(2)若该烃为气态炔烃,则可能的结构简式为: 、 。
(3)若该烃为液态芳香烃,写该烃中相对分子质量最小的烃的分子式 。
23.(本小题6分)电石中的碳化钙和水能完全反应:
CaC2+2H2O=C2H2↑+Ca(OH)2
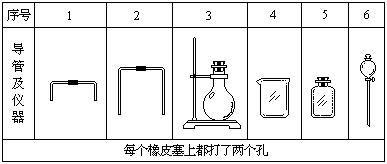 使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量。
使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测定电石中碳化钙的含量。
(1)若用下列仪器和导管组装实验装置:
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、导管的序号)是( )接( )接( )接( )接( )接( )。(2分)
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞。
②检查装置的气密性。.
③在仪器6和5中注入适量水。
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计)。
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞。
正确的操作顺序(用操作编号填写)是 。(2分)
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含
有 杂质。(1分)
(4)若实验时称取的电石1.60克,测量排出水的体积后,折算成标准状况乙炔的体积为448毫升,此电石中碳化钙的百分含量是 %。(1分)
|
|
季碳原子,数目分别用n1、n2、n3、n4表示。例如 分子中n1=6,
n2=1,n3=2,n4=1。试根据不同烷烃的组成和结构,分析出烷烃(除甲烷外)中各原子数的关系。
(1)烷烃分子中氢原子个数为n0。n0与n1、n2、n3、n4的关系是:n0= 或
n0= 。
(2)四种碳原子数之间的关系为n1= 。
(3)若某分子中 n2=n3=n4=1,则该分子的结构简式可能是(写其中一种) 。
22.(9分)实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混和酸,加入反应器中。
②向室温下的混和酸中逐滴加入一定量的苯,充分振荡,混和均匀。
③在55-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)(2分)制备硝基苯的化学方程式为: 。
(2)(2分)配制一定比例浓硫酸与浓硝酸混和酸时,操作注意事项是:
。
(2) (1分)步骤③中,为了使反应在55-60℃下进行,常用的方法是 。
(3) (1分)步骤④中洗涤、分离粗硝基苯应使用的仪器是 。
(4) (1分)步骤④中粗产品用5%NaOH溶液洗涤的目的是
。
(5) (2分)纯硝基苯是无色,密度比水 (填“小”或“大”),具有 气味的油状液体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com