
题目列表(包括答案和解析)
3.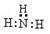 下列有关化学用语表达不正确的是
下列有关化学用语表达不正确的是

 A.氨气分子的电子式: B.CS2分子的结构式: S=C=S
A.氨气分子的电子式: B.CS2分子的结构式: S=C=S
C.S2-的结构示意图: D.苯分子的比例模型:
2.下列有关物质的分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤同素异形体:C60、C70、金刚石、石墨
A.①③④ B.③⑤ C.②③④ D.②④
1.当压力达到220atm、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是
A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应
B.“水热反应”是一种复杂的物理化学变化
C.火力发电厂可以利用废热,将二氧化碳转变为能源物质
D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
26、(6分)用下面改进的方法可以制得白色的Fe(OH)2沉淀。在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
25、(8分)某光卤石(KCl·MgCl2·6H2O)样品中含有不跟NaOH溶液、盐酸反应的杂质。某校化学课外活动研究小组现测定此样品中含有KCl·MgCl2·6H2O的质量分数,经讨论有多种实验测定方案。请根据提供的实验试剂和仪器(所需要的仪器任选),选择精确度较高的实验测定方案,简要写出第二步以后的实验步骤和实验结果。
(1)可选用的实验试剂:
①amol/LNaOH溶液②bmol/LNa2CO3溶液③cmol/LHCl溶液④dmol/LAgNO3溶液⑤酚酞溶液⑥紫色石蕊试液
(2)实验步骤:第一步:称取mg样品,放入250mL容量瓶中,加适量水溶解。
 第二步: ;第三步: ;第四步:
。
第二步: ;第三步: ;第四步:
。
(3)计算样品中含有KCl·MgCl2·6H2O(相对分子质量277.5)的在 质量分数表达式: 。(如果用以上试剂,其体积可分别用AmL、BmL、CmL、DmL表示)
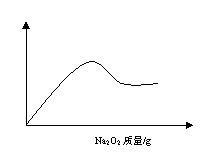
24、(3分)某溶液A可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、CO32-、SO42-等离子中的几种,取部分A溶液,加盐酸酸化后再滴入氯化钡溶液,只出现白色沉淀;另取部分A溶液,加入固体Na2O2有无色、无味的气体产生,并有白色沉淀生成,沉淀的量与所加Na2O2的关系如图所示,据此判断,溶液中一定含有 离子,一定不存在 离子,可能含有 。
23、(4分)甲、乙两瓶溶液,可能是AlCl3和NaOH。向10mL0.2 mol/L甲溶液中滴加未知的乙溶液,测得滴加15mL与45mL时,所得沉淀得质量相等。请回答:
(1)甲溶液为: ,乙溶液为:
(2)滴加45mL乙溶液的过程中发生的离子方程式为: 。
 (3)乙溶液的物质的量浓度为:
。
(3)乙溶液的物质的量浓度为:
。
22、(14分)下列图所示反应有直接进行的,也有在溶液中进行的,其中部分产物已略去。已知:A是固体单质;B、X、H为气体单质;D属于可溶于水的强电解质,一个D分子中含有18个电子。
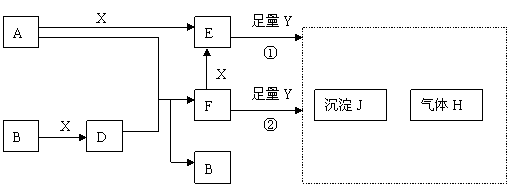

(1)化学式:B为 ,F为 。
(2)用电子式表示D的形成过程为: 。
(3)已知H的密度比空气大,则①中所涉及的反应的化学方程式为:
; 。
(4)写出F与足量Y反应生成J的理由: 。
(5)写出A与D溶液反应生成B的离子方程式: 。
写出A在一定条件下与水反应的化学方程式: 。
21、(3分)某校自产的“××”牌矿泉水,富含锶元素,锶在生物体中是痕量元素(即每日需求量低于0.04g)。根据周期表,请回答下列问题:
(1)请指出锶在元素周期表中的位置: 。(2)氢氧化锶是强碱还是弱碱: 。
(3)请用最简便的方法证明氢氧化锶是强碱还是弱碱: 。
20、某铁的氧化物,用7mol/L的盐酸100mL在一定条件下恰好完全反应,所得溶液中再通入0.56L标准状况下的氯气时,刚好使溶液中Fe2+完全转化为Fe3+,则该氧化物的化学式表示为:
A.FeO B.Fe3O4 C.Fe4O5 D.Fe5O7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com