
题目列表(包括答案和解析)
4.(2002年 广东省佛山市中考题)向6.8g铁和氧化铁的混合物中通入CO,加热反应完全,继续通CO直至冷却、称量为5.6g。将这5.6g固体与足量的盐酸反应制取氧气。试计算:
(1)制得氢气的质量。
(2)混合物中氧气铁的质量分数
2.(2002年,陕西省中考题)为了消除人体碘缺乏病,我国政府规定食用盐必须是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。计算(精确到0.1)
(1)碘酸钾中碘元素的质量分数
(2)若成人每天食用7g碘盐,从中报取0.15mg碘,那么1Kg碘盐中含碘多少毫克?
1.(2002年,甘肃省中考题)2001年诺贝尔化学奖授予了美国化学家诺贝尔斯博士与日本化学家野依良治教授和美国化学家沙普利斯教授,以表彰他们对催化不对称合成的重大贡献。环氧化(R)一丙烯醇(化学式为C3H6O2)是沙普利斯应用不对称合成技术合成的一种重要的物质。该物质用于生产一种治疗心脏病的药物。计算(计算结果保留一位小数):
(1)C3H6O2中碳、氢、氧三种元素的质量比。
(2)该物质中氧元素的质量分数。
1.2克 Y2 Y2=4.4克
一氧化碳的质量分数=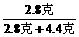 ×100%=38.9%
×100%=38.9%
(2)设生成碳酸钙质量为Z.
Ca(OH)2 + CO2 = CaCO3↓ + H2O
44 100
Y1+Y2=8.8克 Z
Z=20克
答:略.
[习题精练]
2.代入方程式计算的量必须是参加反应的纯净物质的质量
对于题设所给的物质质量,先要根据“完全反应”、“足量”等关键词判断是否全部参加反应,没有全部参加反应的量不能代入方程式;还要判断是否为纯物质,如所给的是混合物,可通过以下公式换算为纯净物;纯物质的质量=不纯物质的质量×某物质的纯度.
如题设所给的是气体的体积,不能直接代入方程式计算,应通过以下公式换算成质量后方可代入:气体的质量=气体的体积×气体的密度.
此外,应注意代入方程式中质量单位要统一.
[典型题例]
例1 求Na2CO3·10H2O的相对分子质量
解 Na2CO3·10H2O的相对分子质量=23×2+12×1+16×3+10×(1×2+16×1)=286
例2 求葡萄糖(C6H12O6)中各元素的质量比
解 C:H:O=12×6:1×12:16×6=6:1:8
例3 求硝酸铵(NH4NO3)中氮元素的质量分数
解
氮元素的质量分数= ×100%
×100%
=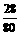 ×100%=35%.
×100%=35%.
例4 已知化合物M由氮和氧两种元素组成,已知380克M中含140克氮,求M的化学式.
解法一 设M的化学式为NxOy,则
380克× =140克
=140克
380克×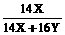 =140克
=140克 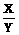 =
=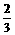 .
.
M的化学式为N2O3.
 解法二 由题意380克M中含(380克-140克)氧,则氮、氧元素质量比=140:240=7:12.
解法二 由题意380克M中含(380克-140克)氧,则氮、氧元素质量比=140:240=7:12.
 氮、氧原子个数比= =
氮、氧原子个数比= =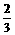 .
.
M的化学式为N2O3.
例5 某硝酸铵样品,经实验分析氮元素质量分数为33.6%,计算该样品中硝酸铵的质量分数.(设杂质不含氮)
解法一 设样品质量为100克,其中含硝酸铵质量为X,则:
X· =100克×33.6%
X=96克
=100克×33.6%
X=96克
硝酸铵的质量分数=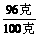 ×100%=96%
×100%=96%
解法二 硝酸铵的质量分数=
= ×100%=96%.
×100%=96%.
例6 尿素的化学式为CO(NH2)2 (1)求等质量的尿素与硝酸铵中氮元素的质量比.(2)100千克尿素含氮量与多少千克NH4HCO3含氮量相等?
解 (1)设尿素与硝酸铵的质量都等于M
M× :M×
:M× =
=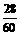 :
: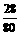 =
=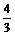 .
.
(2)设质量为X的NH4HCO3含氮量与100千克尿素含氮量相等
X· =100千克×
=100千克×
X=263千克.
例7 某不纯的MnO2粉末,其中只含一种杂质,经测定含氧质量分数为35.8%,则这种杂质可能是( )
A.MgO B.SiO2 C.CuO D.铁粉
解析 MnO2中氧元素质量分数=36.8%,高于样品的含氧量,因此杂质中氧元素质量分数应一定小于35.8%,否则样品的含氧质量分数不可能等于35.8%.将四个选项物质的含氧量分别算出(MgO:40%; SiO2:53.3%; CuO:20%; 铁粉:0%)故应选C、D.
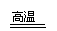
例8 一氧化碳能在高温下还原铁矿石中的氧化铁.用100吨含Fe2O3为80%的铁矿石炼铁,可炼出含铁95%的生铁多少吨?
 解法一 设可炼出生铁质量为X
解法一 设可炼出生铁质量为X
3CO+Fe2O3 2Fe+3CO2
160 112
100吨×80% X·95%
X=58.9吨
解法二 铁矿石中的铁元素在反应前后没有改变,可根据铁矿石和生铁中铁元素质量相等求解.设可炼出生铁质量为X,则:
100吨×80%× =X·95%
=X·95%
X=58.9吨
答:略.
例9 有13.5克干燥纯净的KClO3和MnO2的混合物,其中MnO2的质量分数为20%.把混合物放在试管中加热,当测得MnO2的质量分数占剩余固体的27%时,求已经分解的KClO3质量.
解 MnO2的质量=13.5 克×20%=2.7克
MnO2是催化剂,质量保持不变.则剩余固体质量=2.7克÷27%=10克
根据质量守恒定律,生成氧气的质量=13.5克-10克=3.5克
|
|
 2KClO3 2KCl+3O2↑
2KClO3 2KCl+3O2↑
245 96
X 3.5克
X=8.9克
答:略.
例10 将金属混合物6.63克跟足量稀硫酸反应生成0.3克氢气,则该金属粉末可能是
( )
A.Mg和Fe B.Mg和Al C.Fe和Zn D.Mg和Zn
解析 求该金属混合物的可能组成,这是一道典型的估算题.
先根据化学方程式计算出生成0.3克H2需Mg:3.6克,Fe:8.4克,Zn:9.75克,Al:2.7克(也可根据公式:金属与足量酸反应生成氢气质量= ×金属质量求解.)根据平均组成法,只有一种大于6.63克,一种小于6.63克才有可能.因此选A、D.
×金属质量求解.)根据平均组成法,只有一种大于6.63克,一种小于6.63克才有可能.因此选A、D.
例11 将一定质量的CaCO3和Cu粉置于同一敞口容器中,加热煅烧使其完全反应,反应前后容器内固体的质量不变,则容器中Cu和CaCO3的质量比是( )
A.11:4 B.20:14 C.44:25 D.16:25
解析 对于无数据计算,通过巧设未知量,化抽象为具体,再通过巧抓不变量,找出解决问题的突破口,列出等式.本题发生了两个反应,CaCO3分解造成固体质量减少,减少的质量等于生成的CO2质量,Cu和O2反应造成固体质量增加,增加的质量等于O2质量,由题意CO2质量等于参加反应的O2质量.
 设CaCO3质量为x,Cu质量为y
设CaCO3质量为x,Cu质量为y
CaCO3 CaO+CO2↑ 2Cu + O2 2CuO
100 44 128 32
x
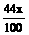 y
y 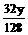
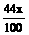 =
=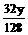
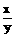 =
=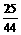 . 答:略.
. 答:略.
例12 将2.4克木炭(不含其它杂质)在氧气中燃烧,反应后气体中不含氧气,当气流通过灼热的氧化铜和足量的石灰水,气体被全部反应完,测知生成铜6.4克.试求(1)气流中一氧化碳的质量分数.(2)生成碳酸钙的质量.
 解
(1)设一氧化碳质量为x,该反应中生成的CO2质量为Y1
解
(1)设一氧化碳质量为x,该反应中生成的CO2质量为Y1
CuO + CO Cu + CO2
28 64 44
X 6.4克 Y1
X=2.8克 Y1=4.4克
生成2.8克CO消耗C:2.8克×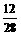 =1.2克,还有(2.4克-1.2克)=1.2克,木炭燃烧生成CO2,设生成CO2质量为Y2.
=1.2克,还有(2.4克-1.2克)=1.2克,木炭燃烧生成CO2,设生成CO2质量为Y2.
 C
+ O2 CO2
C
+ O2 CO2
12克 44
1.掌握正确的解题程序和书写格式
解题一般按以下程序:审题→写出配平的化学方程式→找出关系量→列比例式→求解.
格式的基本要求是步骤严谨、层次分明,一般可按照“解”、“设”、“写”(化学方程式)、“列”(比例式)、“解”(比例式)、“答”(六步来写).
6.注意几个问题
5.足量:有时指适量,有时指过量.其作用在于说明另一反应物已全部反应完.
4.过量:反应完全后,有一种或几种反应物剩余.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com