
题目列表(包括答案和解析)
2. 已知在101KPa时:CH4(g)+2O2(g)=CO2(g)+2H2O(g)
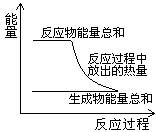
已知在101KPa时:CH4(g)+2O2(g)=CO2(g)+2H2O(g) 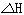 =-820KJ·mol-1。则下列说法中正确的是
( )
=-820KJ·mol-1。则下列说法中正确的是
( )
A.反应过程中的能量变化关系可如右图所示
B.11.2LCH4完全燃烧放出热量410KJ
C.CH4的燃烧热为820KJ
D.凡是有水生成的氧化还原反应都是放热反应
1.下列说法正确的是 ( )
A.反应热是指反应过程中放出的热量
B.1molH2SO4和1molBa(OH)2完全中和所放出的热量为中和热
C.相同条件下,将两份碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
D.物质发生化学变化都伴随着能量变化
22、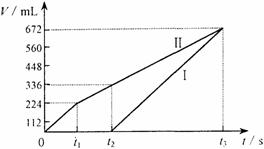 (10分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(10分)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质
的量浓度。
21、(12分)某温度下,在一固定容积的密闭容器中投入一定物质的量的N2与H2进行可逆反应:N2(g)+3H2(g)  2NH3(g) ;在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。
2NH3(g) ;在2 min时达到平衡状态,此时c(N2)=5.00 mol/L,c(H2)=10.00mol/L,c(NH3)=5.00 mol/L。
试求:(1)该温度下,反应的平衡常数是多少?
(2)H2的起始浓度;
(3)用N2表示该反应的反应速率是多少;
(4)N2的转化率(保留三位有效数字);
20.(10分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾反应的离子方程式是 。
 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂 质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂 质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是
。
②通电开始后,阴极附近溶液pH会增大(碱性增强),请简述原因:
。
③除去杂质后氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
19.(8分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液
|
金属 |
电子流动方向 |
电压/V |
|
Fe |
Fe → Cu |
+0.78 |
|
Zn |
Zn → Cu |
+1.10 |
|
A |
Cu → A |
-0.15 |
|
B |
B → Cu |
+0.3 |
里。实验并记录电压指针的移动方向和电压
表的读数如右表:
根据以上实验记录,完成以下填空:
⑴Zn、A、B三种金属活动性由强到弱的顺序
是 。
⑵Cu与A组成的原电池, 为负极,此电极反
应式为 。
⑶A、B形成合金,露置在潮湿空气中, 先被腐蚀,这时正极电极反应式
为 。
18.(10分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
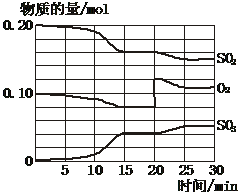
(1)若降低温度,该反应的化学平衡常数_________,化学反应速率_________。(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
17.(8分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l) = H2O(g) ΔH= +44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
16、(6分)下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。
达到平衡时平衡混合物中NH3的含量(体积分数)[ 入料V(N2)∶V(H2)=1∶3]
 NH3 压强/MPa NH3 压强/MPa 的含量 /% 的含量 /%温度/℃ |
0.1 |
10 |
20 |
30 |
60 |
100 |
|
200℃ |
15.3 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
|
300℃ |
2.2 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
|
400℃ |
0.4 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
|
500℃ |
0.1 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
|
600℃ |
0.05 |
4.5 |
9.1 |
13.8 |
23.1 |
31.4 |
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向 方向移动,正反应方向为 反应。
(2)根据平衡移动原理,合成氨适宜的条件是 。
A 高温高压 B 高温低压 C 低温高压 D 低温低压
(3)计算500℃,30MPa时N2的转化率 。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施: 。
15、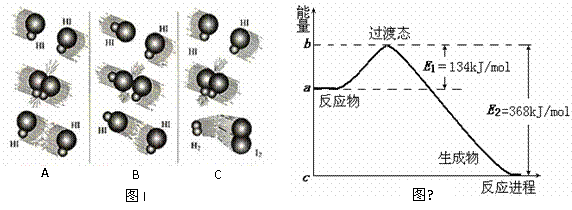 (8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
⑴ 图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
(选填“A”、“B”或“C”);
⑵ 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。
图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: ;
⑶ 请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
⑷ 进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/
kJ·mol–1 |
197 |
360 |
499 |
X |
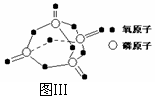
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图Ⅲ所示,则上表中
X= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com