
题目列表(包括答案和解析)
7.在密闭容器中充入A、B两种气体,在一定条件下反应: 2A(g)+B(g) 2C(g) ;ΔH<O.达到平衡后,改变一个条件,下列量(Y)的变化一定符合图中曲线的是 ( )
2C(g) ;ΔH<O.达到平衡后,改变一个条件,下列量(Y)的变化一定符合图中曲线的是 ( )
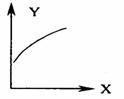
|
6.下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是 ( )
A.

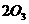 (正反应为吸热反应)
(正反应为吸热反应)
B.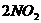

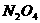 (正反应为放热反应)
(正反应为放热反应)
C.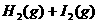

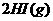 (正反应为放热反应)
(正反应为放热反应)
D.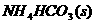

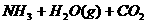 (正反应为吸热反应)
(正反应为吸热反应)
5.对于某一已经建立平衡的可逆反应,当条件改变或采取某些措施时使平衡向正反应方向移动,以下叙述正确的是 ( )
①生成物的质量分数一定增大 生成物的产量一定增加
③反应物的转化率一定增大 反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率
A.②③ B.②④⑤ C.③④⑤ D.②⑤
4.一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是 ( )
2C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是 ( )
A.保持温度和活塞位置不变,在甲中再加入1mol A和2mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t3前的反应速率变化已省略)
图1 图2 图3
3.在一定温度下的恒容容器中,表明反应A(s)+2B(g)  C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强不随时间变化而变化
B.混合气体的密度不随时间变化而变化
C.气体总物质的量不随时间变化而变化
D.单位时间内生成n mol C,同时消耗2n molB
2.下列事实中,不能用勒夏特列原理解释的是 ( )
A.溴水中有下列平衡Br2+H2O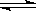 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变
浅
B.对2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
C.反应CO+NO2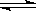 CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
1.在2L容器中发生3A+B=2C的反应在,最初加入的A、B都是4mol,A的反应速率为0.12mol/(L·S),10s后容器内的物质的量为 ( )
A.1.6mol B.2.8mol C.3.2mol D.3.6mol
23.(11分)已知硅能够与氢氧化钠溶液发生反应生成硅酸钠和氢气,其反应方程式为:Si+2NaOH+H2O=NaSiO3+H2↑。现有一块由Na、Al、Si组成的合金投入足量的水中充分反应后得到一澄清透明溶液A,向A中逐滴加入1mol/L的盐酸,当加入100mL时尚无明显变化发生,但若继续滴入此盐酸,溶液中开始出现沉淀,共向该溶液A中滴入700mL该盐酸时得到了质量不再变化的沉淀(即如果再加入酸,沉淀质量不增加也不减少),过滤、洗涤并灼烧沉淀,最终称得质量为6g。求合金的总质量为多少克?
高二化学上学期单元过关题(五)
--综合训练
22.(12分)下图(左)是还原铁粉与水蒸气反应的实验装置,实验时,B中灰色
的铁粉变为黑色,且生成的黑色固体物质是一种可溶于稀盐酸的较复杂化合物。请
回答下列问题:
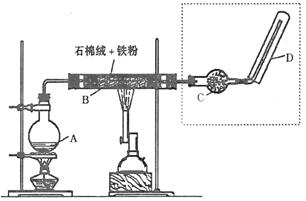
(1)B中发生反应的化学方程式为 。
(2)反应前A中投放碎瓷片的目的是 。
(3)某次实验后,取B中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。
溶液颜色无明显变化,试解释原因 。
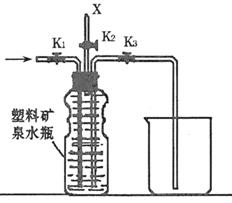
(4)上图(左)中虚线部分,可以用右图所示装置代替,在X口点燃收集到的气
体即可检验H2的存在。实验开始时,打开K1、K2,关闭K3,使反应先进行一段时间
之后,必须进行 操作,方可关闭K2、打开K3,再收集气体。当收集到半
瓶气体时,停止加热,关闭K1,若要使H2顺利逸出而进行点燃实验,操作的方法
是 。
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是
。
21.(8分)从铁、铝合金出发的反应如图:每一步反应都是在敞口的容器中进行,反应物与空气接触足够长的时间。
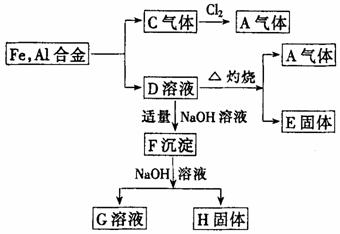
试确定A,C,G,H的化学式:
A ,C ,G ,H 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com