
题目列表(包括答案和解析)
6.意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与
白磷(P4)相同,如右图所示,已知断裂1molN-N键吸收167KJ能量,生成1mol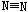 放
放
 出942KJ能量,根据以上信息和数据判断下列说法正确的是 ( )
出942KJ能量,根据以上信息和数据判断下列说法正确的是 ( )
A.N4分子是一种新型化合物
B.N4和N2互为同素异形体
C.N4分子的沸点比白磷分子的高
D.1molN4转变为N2将吸收882KJ的能量
5.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H
=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀
硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
( )
A.△H1>△H2>△H3 B.△H1<△H2<△H3
C.△H1>△H2=△H3 D.△H1=△H2<△H3
4.在25℃、101KPa下,1g甲醇燃烧生成CO2和液态水时放热22.68KJ,下列热化学方程正
确的是 ( )
A.CH3OH(l)+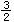 O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452KJ/mol
C.CH3OH(l)+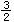 O2(g)=CO2(g)+2H2O(l) ΔH=-725.8KJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=-725.8KJ/mol
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1452KJ/mol
3.下列反应属于吸热反应的是 ( )
A.C6H12O6(葡萄糖aq)+6O2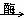 6CO2+6H2O
6CO2+6H2O
B.CH3COOH+KOH=CH3COOK+H2O
C.A+B=C+D;ΔH <0
D.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量
2.下列说法中,正确的是 ( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,
反应为放热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
1.已知热化学方程式:①CO(g) + 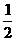 O2 (g)=CO2 (g) ΔH=-283.0kJ·mol-1
O2 (g)=CO2 (g) ΔH=-283.0kJ·mol-1
 ②H2(g)
+
②H2(g)
+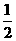 O2 (g) =H2O(g);ΔH=-241.8
kJ·mol-1则下列说法正确的是 (
)
O2 (g) =H2O(g);ΔH=-241.8
kJ·mol-1则下列说法正确的是 (
)
A.H2的燃烧热为241.8kJ·mol-1
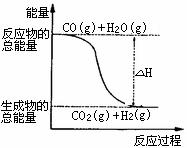
B.由反应①、②可知右图所示的热化学方程式为CO(g)
+H2O(g)=CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g) +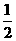 O2 (g) =H2O(l);
O2 (g) =H2O(l);
ΔH>-241.8 kJ·mol-1
21.在一容积可变的密闭容器中,一定条件下进行反应A(g)+3B(g) 2C(g);
已知加入lmol A和5mol B,且达到平衡后生成了1mol C。
(1)达到平衡时,C在反应混合气中的体积分数是________。
(2)保持温度和压强不变,向反应容器中加入2 mol B,为了保持平衡时各气体的体积分数不发生变化,可以再向容器中加人___molA或者加入____molC。
(3)保持温度和压强不变,向原容器中加人一定量的氦气(氦气不与A、R、c反应),重新达到平衡。此时反应混合气中C的物质的量__________(填写“增大”、“减小”或“不变”)。
(4)保持温度和体积不变,向原容器中加人一定量的氦气(氦气不与A、B、C反应),重新达到平衡。此时反应混合气中C的物质的量_________(填写“增大”、“减小”
20.
 在如图所示的三个容积相同的容器①、②、
在如图所示的三个容积相同的容器①、②、
③中进行如下的反应:
3A(g)+B(g) 2C(g) △H<0.
2C(g) △H<0.
(1)若起始温度相同,分别向三个容器中充入3molA
和1molB,则达到平衡时各容器中C物质的百分
含量由大到小的顺序为________(填容器编号)(不考虑活塞质量和摩擦系数) ①外有隔热套 ② ③可移动
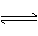 (2)若维持温度不变,起始时②中投入3molA、1molB;③中投入3
molA、1molB和2molC,则达到平衡时,两容器中B的百分含量②_____________③(填<、>或=)
(2)若维持温度不变,起始时②中投入3molA、1molB;③中投入3
molA、1molB和2molC,则达到平衡时,两容器中B的百分含量②_____________③(填<、>或=)
19.(I)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,
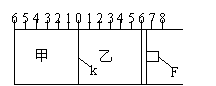 甲中充入2molA和1molB,乙中充入2molC和
甲中充入2molA和1molB,乙中充入2molC和
1molHe,此时K停在0处。在一定条件下发生
可逆反应:2A(g)+B(g) 2C(g);反应达到平衡后,
2C(g);反应达到平衡后,
再恢复至原温度。回答下列问题:
(1)可根据 现象来判断甲、乙
都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处, 则a的取值范围是 。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物
质的量为 mol,乙中C的转化率 50%(填:“>”、“<、”“=”),此时,乙中可移动活塞F最终停留在右侧刻度 处(填下列序号)① <6
② >6 ③ =6。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 ;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于 。
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量分数是 (填:“甲>乙”或“甲<乙”或“甲=乙” );
(2)测得甲中A的转化率为b,则乙中C的转化率为 ;
(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
18.根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。如下图表示298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
(1)若反应中生成2mol氨.则反应 (填“吸热”或“放热”) kJ
(2)在图中曲线 (填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是 ;
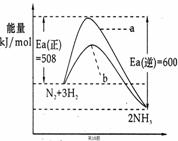 (3)目前合成氨工业广泛采用的反应条件500℃、20~50MPa、
(3)目前合成氨工业广泛采用的反应条件500℃、20~50MPa、
铁触媒,反应转化率不超过50%,工业上为了进一步
提高氨气产率,你认为下列措施最经济可行的是 ;
A.降低反应温度,让反应向着有利氨气生成的方向进行
B.升高温度,让更多的分子变成活化分子
C.寻求能在更低的温度下有很强催化活性的新型催化剂
D.寻求新型耐高压材料,将压强增大一倍
(4)在一定条件下,将3molN2和3molH2充入一个容积固定的密闭容器中发生反应.当反应达到平衡时NH3为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中正确的是 (填编号)。
|
编号 |
起始状态/mol |
||
|
N2 |
H2 |
NH3 |
|
|
① |
2 |
0 |
2 |
|
② |
2.5 |
1.5 |
1 |
|
③ |
8/3 |
2 |
2/3 |
|
④ |
0 |
0 |
2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com