
题目列表(包括答案和解析)
16.(10分)已知下列热化学方程式:①H2(g) +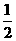 O2 (g) =H2O(l);ΔH=-285
kJ·mol-1
O2 (g) =H2O(l);ΔH=-285
kJ·mol-1
②H2(g)
+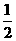 O2 (g) =H2O(g);ΔH=-241.8
kJ·mol-1 ③C(s)
+
O2 (g) =H2O(g);ΔH=-241.8
kJ·mol-1 ③C(s)
+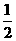 O2 (g) =CO(g);ΔH=-110.5
kJ·mol-1 ④
C(s)
+O2 (g) =CO2(g);ΔH=-393.5
kJ·mol-1 回答下列问题:
O2 (g) =CO(g);ΔH=-110.5
kJ·mol-1 ④
C(s)
+O2 (g) =CO2(g);ΔH=-393.5
kJ·mol-1 回答下列问题:
(1)上述反应中属于放热反应的是 。
(2)H2的燃烧热为 ;C的燃烧热为 。
(3)燃烧10gH2生成液态水,放出的热量为 。
(4)写出CO燃烧的热化学方程式 。
15.已知25℃、101KPa下,4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9KJ/mol 4Al(s)
+2O3(g)=2Al2O3(s) ΔH=-3119.1KJ/mol,由此得出的结论正确的是 ( )
A.等质量的O2比O3能量低,由O2转变为O3为放热反应
B.等质量的O2比O3能量高,由O2转变为O3为吸热反应
C.O3比O2稳定,由O2转变为O3为放热反应
D.O2比O3稳定,由O2转变为O3为吸热反应
第Ⅱ卷(55分)
|
14.已知CH4(g)+2O2(g)=CO2(g)+2H20(l)ΔH=-Q1;2H2(g)+O2(g)=2H20(g)ΔH=-Q2;2H2(g)+O2(g)=2H20(l)ΔH=-Q3;常温下,取体积比为4:1的CH4和H2的混合气体112L(标准状况),经完全燃烧后恢复至常温,则放出的热量为 ( )
A.4Q1+0.5Q3 B.4Q1+0.5Q2 C.4Q1+Q3 D.4Q1+2Q2
13.已知:(1)Zn(s)+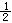 O2(g)=ZnO(s) △H=-348.3kJ·mol-12Ag(s)+
O2(g)=ZnO(s) △H=-348.3kJ·mol-12Ag(s)+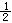 O2(g)
O2(g)
=Ag2O(s)△H=-31.0kJ·mol-1则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于 ( )
A.-317.3kJ·mol-1 B.-379.3kJ·mol-1
C.-332.8kJ·mol-1 D.+317.3kJ·mol-1
12.利用储能介质储存太阳能的原理是:白天在太阳光照射下某种固态盐熔化(实际上是盐溶于自身的结晶水)吸收能量;晚间熔盐释放出相应能量而凝固,这样使室温得以调节。已知几种盐的熔点及其熔化时能量改变值如下所示:
|
盐 |
熔点(℃) |
盐熔化时吸热(KJ/mol) |
|
CaCl2·6H2O |
29.0 |
37.3 |
|
Na2SO4·10H2O |
32.4 |
77.0 |
|
Na2HPO4·12H2O |
36.1 |
100.1 |
|
Na2S2O3·5H2O |
48.5 |
49.7 |
下列说法正确的是 ( )
①不应选用CaCl2·6H2O ②可选用Na2SO4·10H2O和Na2HPO4·12H2O
③最好选用Na2SO4·10H2O,它更经济 ④以上皆不宜选用
A.① B.①③ C.②③ D.④
11.下列各组物质的燃烧热相等的是 ( )
A.碳和一氧化碳 B. 1molC和2molC C. 3molC2H2和1molC6H6 D. 淀粉和纤维素
9.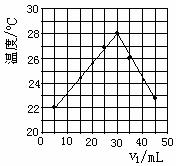 将V1mL1.00mol/L的HCl溶液和V2mL未知浓度的NaOH
将V1mL1.00mol/L的HCl溶液和V2mL未知浓度的NaOH
溶液混合均匀后测量并记录溶液 温度,实验结果如右
图所示(实验中始终保持V1+V2= 50mL)。下列叙述正
确的是 ( )
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00mol/L
D.该实验表明有水生成的反应都是放热反应
|
A.80% B.60% C.40% D.20%
8.近年来,科学家正在探索利用铝粉作燃料的可能性,以期铝能成为一种石油的替代物。
假如铝作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法,你认为
错误的选项是 ( )
A.铝质轻,便于运输,且安全
B.铝燃烧时放出的热量多,且燃烧后的产物对环境的污染容易得到有效控制
C.在地球上,铝矿资源丰富
D.现代电冶铝的工业技术已经可以将铝转化为一种廉价的新型能源
0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3KJ
D.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学
方程式表示为:2H2(g)+O2(g)=2H20(l)ΔH=+285.8KJ/mol
7.下列说法或表示方法正确的是 ( )
A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由“C(石墨)→C(金刚石) ΔH=+1.9KJ/mol”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ·mol-1,若将含
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com