
题目列表(包括答案和解析)
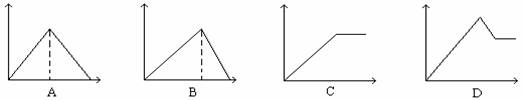
5.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
4.将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为 ( )
A.0.1mol/L B.0.05mol/L C.0.2mol/L D.无法计算
3.在含有0.078mol FeCl2的溶液中通入0.009mol Cl2,再向其中加入含0.01mol X2O72-的酸性溶液,使溶液中Fe2+ 的恰好完全被氧化,且X2O72-被还原成Xn+,则n值为 ( )
A.2 B.3 C.4 D.5
2.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4酸溶液 ③加少量NH4SCN
A.③ ① B.③ ② ① C.① ③ D.① ② ③
1.下列物质的用途正确的是 ( )
A.铁制品在干燥的空气中易生锈
B.使用明矾可除去水中的可溶性杂质离子
C.回收废电池的目的是将它们投放到农村去使用
D.含磷洗涤剂和氮肥的污水排放造成水生植物大量繁殖
21.(12分)标准状况下1.68L五色可燃气体在足量氧气中完全燃烧。若将产物通过足量的
澄清石灰水中,得到的白色沉淀质量为15.0g;若用足量碱石灰吸收燃烧产物,增重9.3g。
|
可能用到的燃烧热 |
C2H4 |
C3H6 |
C3H8 |
|
单位:KJ/mol |
1411 |
2092 |
2220 |
(1)计算燃烧产物中水的质量。
(2)若气体是单一气体,它完全燃烧放出的热量是 。
(3)若原气体是两种等物质的量的气体混合物,其中一种是烃,另一种气体的燃烧热为287KJ/mol,混合气体完全燃烧共放热94KJ,则该烃燃烧的热化学方程式为 。
20.(8分)磷在氧气中燃烧,可能生成两种固态氧化物
P2O3和P2O5,现将3.1g的单质磷(P)在3.2g氧气中燃烧至反应物耗尽,并放出X kJ的热量。
(1)反应后生成物的组成(用化学式表示)是 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1molP与O2反应生成固态P2O3的反应热ΔH= 。
(3)若3.1g磷在3.6g氧气中燃烧,至反应物耗尽,并放出Z kJ的热量,则X Z(填“<”“>”或“=”)
(4)磷的两种氧化物中,较稳定的是 。
19.(10分)下图是某同学设计的探究反应热效应的观察装置。
其操作顺序是:
①按图所示将实验装置连接好。
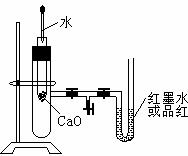 ②在U型管内加入少量红墨水溶液(或品红)。打开T型管螺旋夹,使U型管内两边的液面处于同一水平面,再夹紧螺旋夹。
②在U型管内加入少量红墨水溶液(或品红)。打开T型管螺旋夹,使U型管内两边的液面处于同一水平面,再夹紧螺旋夹。
③在中间的试管里盛有1g氧化钙,当滴入2mL左右的蒸馏水后,即可观察。
试回答:
(1)实验中观察到的现象是 。
(2)该实验中必须进行的一步实验操作是 。
(3)该实验的原理是 。
(4)实验中进行的化学方程式是 。
(5)该实验表明CaO和H2O的能量与Ca(OH)2的
能量之间的关系为 。
18.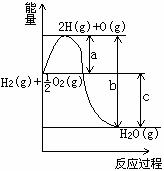 (7分)已知:H2(g) +
(7分)已知:H2(g) +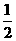 O2 (g) =H2O(g),反应
O2 (g) =H2O(g),反应
过程中能量变化如右图所示,回答:
(1)a、b、c分别代表的意义是:a ;
b ;c 。
(2)该反应是放热反应还是吸热反应? ,
ΔH 0(填“<”或“>”=。
17.(8分)煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a. C(s) +O2(g) =CO2(g);ΔH=E1 ①
b.C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)
+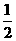 O2(g) =H2O(g);ΔH=E3
③
O2(g) =H2O(g);ΔH=E3
③
CO(g)
+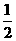 O2(g) =CO2(g);ΔH=E4 ④,试回答下列问题
O2(g) =CO2(g);ΔH=E4 ④,试回答下列问题
(1)与途径a相比,途径b有较多的优点,即 。
(2)上述四个热化学方程式中ΔH>0的反应有 。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是 。
A.a比b多 B. a比b少 C. a与b在理论上相同 D. 两者无法比较
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com