
题目列表(包括答案和解析)
17.(1)2Fe3++Cu=2Fe2++Cu2+
(2)装置图(见右图)
正极:Fe3++e-=Fe2+ (或2Fe3++2e-=2Fe2+)
负极:Cu=Cu2++2e- (或Cu-2e-=Cu2+)
(3)① 通入足量氯气将Fe2+氧化成Fe3+;② 加入CuO调节溶液的PH至3.2-4.7;
③ 过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu
不锈钢表面有紫红色物质生成。
16.(1)PbO2+4H++SO42-+2e-=PbSO4+2H2O 、小 、48
 (2)Pb PbO2 对换
(2)Pb PbO2 对换
(3)5.0×10-3 (4)通入112mlHCl气体
11.C 12.C 13.D 14.A 15.C
1.D 2.B 3.D 4.C 5.C 6.C 7.A 8.D 9.A 10.C
21.(4分)在25℃时,用石墨电极电解2.0L 2.5mol/L CuSO4溶液,
如有0.20mol电子发生转移,请回答下列问题:
(1)电解后得到的铜的质量是 ,溶液的PH是 ;
(2)如用等质量的两块铜片代替石墨做电极,电解后两铜片的
质量差为 ,电解液的PH (填“升高”、
“降低”或“不变”)。
|
20.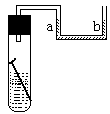 (8分)如下图所示,试管内放一铁钉,溶液为氯化钠溶液,数天后观察到的现象有 。说明铁钉发生了
腐蚀,其中正极的电极反应式为
,溶液中发生的化学反应方程式为
。
(8分)如下图所示,试管内放一铁钉,溶液为氯化钠溶液,数天后观察到的现象有 。说明铁钉发生了
腐蚀,其中正极的电极反应式为
,溶液中发生的化学反应方程式为
。
18.(10分)面对日益加剧的能源危机,中科院院士何祚庥在2003年就曾经倡议大力发展替代能源,如风能、电能等等,要大力开发电动自行车,电动自行车、电动汽车。2006年12月上旬,年产2万辆纯电动汽车的研发基地在天津奠基。回答下列问题:
(1)下列物质中可以作为燃料电池的负极反应物的是 ( )
A.CH4 B.H2 C.C2H5OH D.CO2
(2)若用CH4作燃料,氢氧化钾溶液作电解质溶液,写出负极上的电极反应式 ,电池工作时的总反应式是 。
(3)电池工作时,负极附近溶液的PH (填“升高”、“降低”或“不变”),溶液中KOH的物质的量浓度 (填“增大”、“减小”或“不变”)。
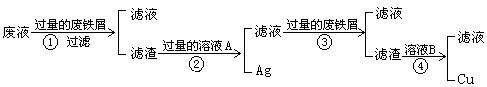 19. (12分)某化学兴趣小组通过测定反应后生成气体的量,完成了用浓硝酸测定铜银合金的质量分数,实验完成后,老师提醒反应的废液中含有较多的铜离子与银离子,应该分别回收利用,于是该小组又设计了下列回收方案:
19. (12分)某化学兴趣小组通过测定反应后生成气体的量,完成了用浓硝酸测定铜银合金的质量分数,实验完成后,老师提醒反应的废液中含有较多的铜离子与银离子,应该分别回收利用,于是该小组又设计了下列回收方案:
(1)在上面的回收方案中,4步都用到了过滤操作,请写出过滤操作中用到的玻璃仪
器 。
(2)写出步骤②中实现Cu与Ag分离的化学方程式 ,请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
在上面设计的原电池的负极观察到的现象为 。
(3)经步骤③后得到的滤液直接加热不能得到该溶质固体盐,原因是 。
(4)在上述操作中回收的铜、银的纯度不高,常需进一步进行电解精炼,请写出电解精炼铜时的阳极材料名称及电极反应方程式 、 。
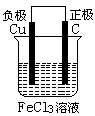
17.(11分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式:正极反应 ,负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式 、 。
劣质不锈钢腐蚀的实验现象: 。
16.(10分)铅蓄电池是典型的可充电电池,它的正负极是惰性材料,电池总反应式为:
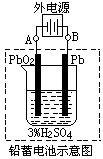 Pb+PbO2+2H2SO4
Pb+PbO2+2H2SO4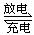 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是 ;电解液中H2SO4的浓
度将变 ;当外电路通过1mol电子时,理论上负极板的质
量增加 g。
(2)在完全放电耗尽Pb和PbO2时,若按上图连接,电解一段时间
后,在A电极上生成 、B电极上生成 ,此时铅
蓄电池的正负极的极性将 。
(3)若用此蓄电池电解NaCl溶液,电解池阳极得到56ml气体,蓄电池中消耗
H2SO4 mol。
(4)电解后的溶液如要恢复原状,应采取的措施为 。
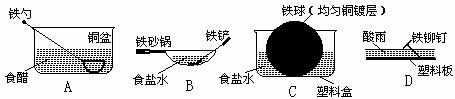
15.相同材质的铁在下列情形下最不易被腐蚀的是 ( )
第Ⅱ卷(55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com