
题目列表(包括答案和解析)
17.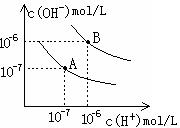 (12分)设水的电离平衡线如右图所示:
(12分)设水的电离平衡线如右图所示:
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度
上升到100℃时,水的电离平衡状态到B点,则此时水的离
子积从 增加到 ,造成水的离子积增大的
原因是 。
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持
100℃的恒温,欲使混合溶液PH=7,则Ba(OH)2与盐酸的体积比为 。
(3)100℃时,已知某强酸溶液的PH酸与某强碱溶液的PH碱存在如下关系:PH酸+
PH碱=13,若要使该强酸与该强碱混合后溶液呈中性,则该强酸的体积与强碱的体积之比为 。
(4)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m。在某温度下,Ca(OH)2的溶解
度为0.74g,其饱和溶液的密度设为1g/ml,其离子积为 。
16.(8分)(1)将等质量的Zn粉分别投入:a:10ml 0.1mol·L-1 HCl和b:10ml 0.1mol·L-1醋酸中。
①若Zn不足量,则反应速率a b(填“>”“<”或“=”)
②若Zn过量,产生H2的量a b(填“>”“<”或“=”) (2)将等质量Zn粉分别投入PH=1体积均为10ml的a:盐酸 b:醋酸中
①若Zn不足量,则反应速率a b(填“>”“<”或“=”)
②若Zn过量,产生H2的量a b(填“>”“<”或“=”)
15.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是 ( )
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目
|
14.向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴加一滴Na2S溶液并振荡,沉淀又变为黑色。根据上述变化过程,分析此三种沉淀的溶解度关系为 ( )
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
13.A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、NaHSO4溶液、BaCl2溶液中的一种,已知A、B溶液的PH相同,A、C混合后溶液变混浊,下列说法正确的是
( )
A. D溶液的PH<7
B. C溶液的溶质溶于水促进了水的电离
C. 溶液A滴入到碳酸氢钠溶液中产生气体
D. 溶液B进行焰色反应呈黄色
12.已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA和NaB混合溶液中,下列排列正确的是 ( )
A.c(OH-)>c(HA)>c(HB) >c(H+) B. c(OH-)>c(A-)>c(B-) >c(H+)
C. c(OH-)>c(B-)>c(A-) >c(H+) D. c(OH-)>c(HB)>c(HA) >c(H+)
11.下列溶液中有关物质的量浓度关系正确的是 ( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
10.为了配制NH4+与Cl-浓度比1:1的溶液,可在NH4Cl溶液中加入① 适量HCl,② 适量NaCl,③ 适量氨水 ④ 适量NaOH ( )
A. ①② B. ③ C. ③④ D. ④
|
9.实验室现有3种酸碱指示剂,基PH变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0
酚酞:8.2~10.0,用0.1000mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是 ( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
8.取浓度相等的NaOH和HCl溶液,以3∶2体积比相混和,所得溶液的PH等于12,则原溶液的浓度为 ( )
A.0.01mol/L B.0.017mol/L C.0.05mol/L D.0.50mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com