
题目列表(包括答案和解析)
19.(1)(NH4)2CO3<(NH4)2SO4<(NH4)2Fe(SO4)2 (2)B
(3)B ; 逐滴加入的盐酸中的H+先和溶液中的CO32-发生反应:CO32-+H+=HCO3-,而后发生H++HCO3-=H2O+CO2↑,故溶液中碳酸氢根离子浓度变化趋势是先逐渐增大而后减小。
18.(1)K=c(NH4+)·c(OH-)/c(NH3·H2O) ; 红 ; > 。 (2)= ;>
(3)逐渐变小 ;1000:13(或77:1)
17.(1)10-14、10-12 、温度升高,水的电离程度增大,溶液中的H+、OH-浓度增大。
(2)2:9 (3) 10:1 (4)0.004
16.(1) ① a>b ② a=b (2) ① a<b ② a<b
11.A 12.A 13.C 14.C 15.B
1.B 2.D 3.B 4.D 5.A 6.D 7.B 8.C 9.D 10.B
21.(5分)难溶电解质的水溶液中存在着电离平衡,在常温下,溶液中各离子浓度的计量系数次方的乘积是一个常数,该常数叫该物质的溶度积常数(Ksp)。
例如:Cu(OH)2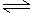 Cu2+(aq)+2OH-(aq) ,Ksp=c(Cu2+)·c2(OH-)=2.0×10-20 当溶液中各离子浓度的计量系数次方的乘积大于溶度积时,则产生沉淀,反之,沉淀溶解。
Cu2+(aq)+2OH-(aq) ,Ksp=c(Cu2+)·c2(OH-)=2.0×10-20 当溶液中各离子浓度的计量系数次方的乘积大于溶度积时,则产生沉淀,反之,沉淀溶解。
(1)某CuSO4溶液里c(Cu2+)=0.02mol/L,若要生成Cu(OH)2沉淀,应调节溶液的PH,使之大于 才能达到目的。
(2)要使0.2mol/LCuSO4溶液中Cu2+沉淀完全[c(Cu2+)≤10-5],则可向溶液里加入NaOH溶液,使溶液的PH为 。(已知:4.472=20 ;lg4.47=0.65)
|
20.(10分)一定物质的量浓度溶液的配制和中和滴定实验是中学化学中几个重要的定量实验之一。
现有下列仪器和用品:① 铁架台(含铁圈、各式铁夹)② 锥形瓶 ③ 酸式和碱式滴定管 ④ 烧杯(若干)⑤ 玻璃棒 ⑥ 胶头滴管 ⑦天平(含砝码)⑧ 量筒 ⑨ 药匙
现有下列药品:A. NaOH固体 B. 标准NaOH溶液 C. 未知浓度的盐酸 D. 蒸馏水
(1)请回答下列问题:
① 配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是 。
② 在酸碱中和滴定时,还缺少的试剂是 。
③ 进行中和滴定实验时,不可用溶液润洗的仪器是 。
A.酸式滴定管 B. 碱式滴定管 C. 锥形瓶
(2)氧化还原滴定实验(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)与中和滴定实验类似。现有0.1000mol/L的酸性KMnO4溶液和未知浓度的无色NaHSO3溶液,反应的离子方程式是:MnO4-+HSO3-+H+→Mn2++SO42-+H2O (未配平)
试回答下列问题:
①滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面,刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积 (填“多”或“少”)。
②若达到滴定终点时,所消耗KMnO4溶液和NaHSO3溶液体积比为4:5,则NaHSO3溶液的物质的量浓度为 mol/L。
19.(11分)(1)在25℃时,1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2溶液中,c(NH4+)由小到大的顺序是 。
(2)用物质的量都是0.1mol的CH3COOH和CH3COONa在常温下配成1L混合溶液,已知其中的c(CH3COO->c(Na+),则对该混合溶液的下列判断中,正确的是 。
① c(H+)>c(OH-) ② c(CH3COO-)+c(CH3COOH)=0.2mol/L
③ c(CH3COO-)<c(CH3COOH) ④ c(OH-)+c(CH3COOH)=0.1mol/L
A. 只有② B. ①和② C. ①②③ D. 全部正确
(3)向碳酸钠溶液中逐滴加入稀盐酸,直到不再生成CO2为止,在此过程中,溶液中碳酸氢根离子浓度变化趋势可能是:
A. 逐渐减小 B. 先逐渐增大而后减小
C. 逐渐增大 D. 先逐渐减小而后增大
你选择的是 (填正确选项的标号),试用化学方程式和简要的文字说明你选择的理由 。
(4)常温下将0.010mol CH3COONa和0.004mol HCl溶于水,配制成0.5L混合溶液,判断:① 溶液中共有 种微粒;
② 溶液中两种微粒的物质的量之和一定等于0.010mol,它们是 和 。 ③ 溶液中n(CH3COO-)+n(OH-)-n(H+)为 mol。
18.(9分)25℃时,在0.1L 0.1mol/L的氨水中逐滴加入同浓度的盐酸直至过量(不计两者的挥发性),回答下列问题:
(1)经测定,25℃时,0.1L 0.1mol/L的氨水溶液中c(OH-)=1.3×10-3mol/L,此时一水和氨的电离平衡常数的表达式为 。若向该氨水中滴加少量酚酞试液,则溶液呈 色,若将上述浓度的氨水稀释10倍,则c(OH-) 1.3×10-4mol/L(用“>”、“<”或“=”填空)。
(2)当溶液的PH=7时,溶液中c(NH4+) c(Cl-)(用“>”、“<”或“=”填空,下同);当盐酸与氨水溶液恰好中和时,溶液中的c(H+) c(OH-)。
(3)在上述实验中,该溶液的PH变化趋势为 ;25℃时,在浓度均为 0.1mol/L的氨水和盐酸中,由水电离出来的c(H+)之比约为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com