
题目列表(包括答案和解析)
20.(12分)选酚酞作指示剂,用中和滴定法测定烧碱样品的纯度(所含杂质不与盐酸反应)。试根据实验回答:
(1)准确称取4.1 g烧碱样品,所用仪器有 。
(2)将样品配成250 mL待测液,需要的仪器有 。
(3)用0.2010 mol / L标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视 ,直到滴定终点。
(4)判断到达滴定终点的实验现象是 。 (5)根据下列数据计算,待测烧碱溶液的浓度为 。(计算结果保留四位有效数字,下同)
|
滴定次数 |
待测液体积
(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
(6) 根据上述数据计算,烧碱样品的纯度为 。
19.(10分)(原创)常温下,复盐十二水合硫酸铝铵[ NH4Al(SO4)2 • 12H2O ]为无色、
易溶于水的晶体。请回答下列问题:
(1)硫酸铝铵在水溶液中的电离方程式为 。
(2)若将硫酸铝铵溶液加水稀释,其溶液的pH将 (填“增大”、“减小”、“不变”)。
(3)若向硫酸铝铵溶液中边振荡边滴加浓NaOH溶液至过量,将依次发生三个离子反应,
请按反应的先后顺序写出离子方程式① ② ③ 。
提示:NH4+ + AlO2- + H2O === NH3 ↑+ Al(OH)3↓
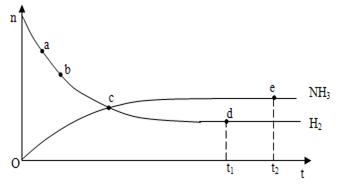
18. 合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g), (正反应为放热反应); 673K、30Mpa下n(NH3)和n(H2)随时间变
2NH3(g), (正反应为放热反应); 673K、30Mpa下n(NH3)和n(H2)随时间变
化的关系如下图所示,下列叙述正确的是 A. a点的反应速率比b点的小 B. c点处反应达到平衡 C. d点(t1时刻)和e点(t2时刻)处n(N2)不一样 D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
第Ⅱ卷(非选择题,共56分)
本卷共5题,共56分。
17.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应物和水分别
离解成两部分,然后两两重新结合成新的物质。据此判断,下列说法不正确的是
A.NH4Cl的水解产物之一为HCl
B. Mg3N2的水解产物是Mg(OH)2和NH3
C. CaO2的水解产物是Ca(OH)2和H2O2
D. PCl3的水解产物是HClO和PH3
16.在pH = 3的FeCl3溶液和pH = 3的盐酸中,由水电离出来的H+的浓度分别为C1、C2,pH = 11的Na2CO3溶液中水电离出来的OH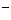 的浓度为C3 , 则它们之间的关系是
的浓度为C3 , 则它们之间的关系是
A. C1<C2<C3 B. C1=C3>C2 C. C1>C2>C3 D. 无法判断
15.在下列各组离子中, 一定能大量共存的是
A. pH = 0的无色溶液中: Na+ 、K+、MnO4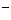 、NO3
、NO3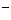
B.含大量Al3+的溶液中: Na+ 、NH4+、SO42- 、Cl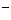
C. 0.1 mol / L的醋酸溶液中: Ca2+、ClO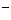 、Mg2+、 K+
、Mg2+、 K+
D.c(
H+) / c( OH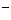 ) =1×1012的溶液中: Ca2+、 K+、OH
) =1×1012的溶液中: Ca2+、 K+、OH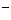 、Cl
、Cl
13.某温度下,在固定容积的密闭容器中,可逆反应A(g)+ 3B(g) 2C(g)达到平衡时,各物质的物质的量之比n(A)∶n(B)∶n(C)=2∶2∶1 , 保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C , 则下列说法正确的是
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,正反应速率增大,逆反应速率减小
2C(g)达到平衡时,各物质的物质的量之比n(A)∶n(B)∶n(C)=2∶2∶1 , 保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C , 则下列说法正确的是
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,正反应速率增大,逆反应速率减小
D. 再达平衡时,C的体积分数增大 14.有五种化合物:① NaHCO3 ② (NH4)2CO3 ③ AlCl3 ④ Al(OH)3 ⑤ NaAlO2 ,其中既能与氢氧化钠溶液反应, 又能与盐酸反应的是 A. ①②④ B. ③④⑤
C. ②④⑤ D. ①②③④⑤
12. 25℃时,水的电离达到平衡:H2O  H++OH
H++OH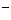 ,下列叙述正确的是
,下列叙述正确的是
A.向水中通入HCl,平衡逆向移动,c(H+)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
10.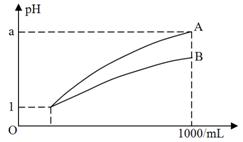 pH
=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如下图示,下列说法不正确的是
A. 两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
11.在物质的量浓度均为0.01 mol / L的CH3COOH和CH3COONa混合溶液中, 测得c(CH3COO-) > c(Na+),则下列关系式正确的是
pH
=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如下图示,下列说法不正确的是
A. 两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
11.在物质的量浓度均为0.01 mol / L的CH3COOH和CH3COONa混合溶液中, 测得c(CH3COO-) > c(Na+),则下列关系式正确的是
A. c(OH-) > c(H+) B. c(OH-) = c(H+)
C. c(CH3COOH) > c(CH3COO-) D. c(CH3COOH) + c(CH3COO-) =0.02 mol / L
9. 下列操作能达到预期实验目的的是
A.为了减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
B.滴定管洗净后,经蒸馏水润洗即可注入标准液进行滴定
C.为了更快得到氢气,可用锌粒代替锌片与盐酸反应
D.湿润的pH试纸用于常见气体的酸碱性检验和未知溶液的pH测定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com