
题目列表(包括答案和解析)
7.下列物质中,其水溶液能导电溶于水时化学键被破坏的非电解质是 ( )
A. 盐酸 B. 硫酸钡 C. 乙醇 D. 二氧化硫
6. 同温同压下,在3支同体积的试管中充入等体积的混合气体它们是:①NO. NO2②NO2. O2③NH3. N2,将这三支试管均倒放与水槽中,充分反应后,试管中剩余的气体体积分别是V1. V2. V3,下列关系正确的是 ( )
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3>V1 D. V3>V1>V2
5.在一定温度下,将CO和水蒸汽各1mol放在密闭容器中反应CO+H2O CO2+H2达到平衡时测得二氧化碳为0.6mol,再通入4mol水蒸气达到新的平衡时二氧化碳的物质的量为( )
CO2+H2达到平衡时测得二氧化碳为0.6mol,再通入4mol水蒸气达到新的平衡时二氧化碳的物质的量为( )
A. 等于0.6mol B. 等于1mol
C. 大于1mol D. 大于0.6mol小于1mol
4.1999年曾经报道合成和分离了含高能量的N5+的化合物N5AsF6,下列叙述错误的是( )
A. N5+共有34个核外电子 B. N5+中氮原子之间以共价键结合
C. N5AsF6中As的化合价为+1价 D. N5AsF6中As的化合价为-1价
3.对于2SO2+O2  2SO3下列判断正确的是
(
)
2SO3下列判断正确的是
(
)
A. 其他条件不变,增大压强,平衡必定向右移动
B. 2体积二氧化硫与足量的氧气反应必定生成2体积的三氧化硫
C. 二氧化硫消耗的速率必定等于氧气生成速率的2倍
D. 平衡时二氧化硫的浓度必定等于氧气的浓度的2倍
2.对与反应N2+3H2 2NH3 以下表示的反应速率中最快的是
( )
2NH3 以下表示的反应速率中最快的是
( )
A.V(N2)=0.4mol·l-1·min-1 B.V(H2)=0.8mol·(l·min)-1
C.V(NH3)=0.6mol·(l·min)-1 D.V(N2)=0.01 mol·(l-1·s)-1
1.安全火柴的侧面涂的物质是 ( )
A.白磷和三硫化化二锑等 B. 红磷和三硫化二锑
C. 氯酸钾. 二氧化锰. 硫等 D. 硝酸钾. 二氧化锰. 硫等
23.(12分) 常温下,已知pH=2的高碘酸 (H5IO6)溶液与pH=12的NaOH溶液等体
积混合,所得混合溶液显酸性。0.01 mol / L的碘酸 (HIO3)或高锰酸 (HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得混合溶液显中性。请回答下列问题: (1)高碘酸是 (填“强酸”或“弱酸”),理由是 。在Na5IO6溶液中c(IO65-)、c(Na+)、c(H+)、c(OH-)由大到小的顺序是 。 (2)已知高碘酸是白色固体,熔融时分解生成的含碘物质为碘酸。写出高碘酸熔融时分解的化学方程式 。 (3)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,反应的离子方程式可表示为 。试比较高碘酸和高锰酸的氧化性强弱 。
命题:郑蓉 雷平
22.(12分)X、Y、Z是中学化学中常见元素的单质,甲、乙是两种常见的化合物,相
|

请回答下列问题:
(1)若X为金属单质,Y为固体非金属单质,则甲的电子式为 ,乙的化学
为 。
(2)若X、Y均为金属单质,甲为红棕色固体,则X与甲反应的化学方程式
为 ,其反应类型为 。试写出X与
NaOH溶液反应的离子方程式: 。
(3)若X、Y均为气体非金属单质,常温下甲为无色液体,则X与甲反应的化学方程式为
。
21.(10分)下图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2 mol X、2 mol Y,起始时,VA=a L,VB=0.8 a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生反应:3X (g) + 3Y (g) 2Z(g)
+ 2W(g),达到平衡时,VB=0.6 a L。试回答下列问题:
2Z(g)
+ 2W(g),达到平衡时,VB=0.6 a L。试回答下列问题:
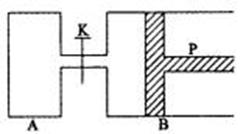 (1) B中达到平衡时X的转化率为 。
(2) A、B中X的转化率的关系是A
B(填“>”,“=”,“<”)。
(3)平衡时A、B中混合气体的平均摩尔质量的关系是:
(1) B中达到平衡时X的转化率为 。
(2) A、B中X的转化率的关系是A
B(填“>”,“=”,“<”)。
(3)平衡时A、B中混合气体的平均摩尔质量的关系是: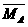
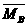 (填“>”,“=”,“<”)
(4)如果要计算出平衡时B中混合气体的密度,则至少还需要知道的是 (MX、MY、Mz、MW分别表示X、Y、Z、W的摩尔质量)。
① MX ② MY ③ Mz ④ MW
A. ③和④ B.①和② C.①和③ D.②③④
(5)打开K,一段时间后反应再次达到平衡,则B中气体的体积为 L。
(填“>”,“=”,“<”)
(4)如果要计算出平衡时B中混合气体的密度,则至少还需要知道的是 (MX、MY、Mz、MW分别表示X、Y、Z、W的摩尔质量)。
① MX ② MY ③ Mz ④ MW
A. ③和④ B.①和② C.①和③ D.②③④
(5)打开K,一段时间后反应再次达到平衡,则B中气体的体积为 L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com