
题目列表(包括答案和解析)
4.下列气体中,只能用排水法收集的是
A.氨气 B.氯气
C.二氧化硫 D.乙烯
3.下列化合物中,只有离子键的是
A.NH4Cl B.NaOH
C.KCl D.NH3
2.下列各组物质中,互为同位素的是
A.O2和O3 B.21H和31H
C.CO和CO2 D.CH4和C3H8
1.下列物质中,硫元素的化合价最低的是
A.H2S B.S
C.SO2 D.SO3
25.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) 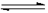 CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:
(1)该反应的化学平衡常数K = 。
(2)该反应为 反应。(填“吸热”或“放热”)
(3)800℃,固定容积的密闭容器中,放入混合物,起始浓度为c(CO) =0.01mol/L,
c(H2O) =0.03mol/L, c(CO2) =0.01mol/L, c(H2) =0.05mol/L ,则反应开始时,H2O的消耗速率比生成速率 (填“大”“小”或“不能确定”)
(4) 830℃,在1L的固定容器的密闭容器中放入2molCO2和1molH2,平衡后H2的转化率为 .
24.(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图A、图B所示的实验。 (1)图A可通过观察 定性比较得出结论。
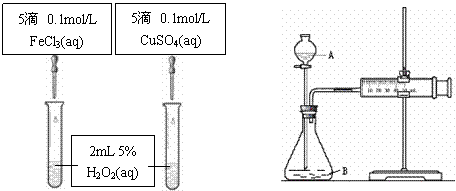 有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进?
有同学提出将CuSO4改为CuCl2更为合理,其理由是 ,你认为还可以作何改进?
图A 图B
(2)检查图B装置气密性的方法是
图B所示实验中需测量的数据是
0.55 mol/LNaOH溶液在如图所示的装置进行中和
热测定的实验,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 (量 筒除外)__________________
(2)为保证该实验成功采取了许多措施,如图的碎塑料泡沫的作用在于____________________
(3)用60mL0.50 mol/L盐酸与50mL0.55 mol/LNaOH 溶液进行反应,与上述实验相比,所 求的中和热____________ (填“相等”“ 不相等”)
(4)用正确的方法测得含有11.2g KOH的稀溶液与1L0.1 mol/L的H2SO4溶液反应,放出11.46KJ热量,该反应的中和热化学方程式是__________________________________
23.(8分)某同学利用50mL0.50 mol/L盐酸与50mL
21.(14分)反应A(g)+B(g)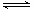 C(g)
+D(g) 过程中的能量变化如图所示,回答下列问题:
C(g)
+D(g) 过程中的能量变化如图所示,回答下列问题:
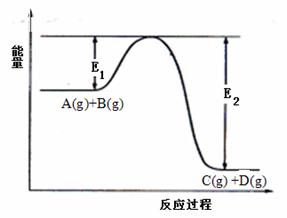 (1)
该反应是________________反应(填“吸热”“放热”);
(1)
该反应是________________反应(填“吸热”“放热”);
△H (填“< 0”或“> 0”)。
(2) 当反应达到平衡时,升高温度, A的转化率____________ (填“增大”“减 小”“不变”),
原因是________________________
(3)反应体系中加入催化剂对反应热是否有影响?_______________ ____________________
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
22(10分)(1)对于反应:C(s)+H2O(g)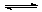 H2(g)+CO(g)在密闭容器中进行,其他条件不变,改变下列条件能加快正反应速率的是
A.将容器体积缩小一半使压强增大 B.体积不变充入H2O(g)使压强增大
C.体积不变充入He气使压强增大 D.压强不变充入N2使体积增大
E.体积不变升高温度使压强增大 F.增加C的投入量
H2(g)+CO(g)在密闭容器中进行,其他条件不变,改变下列条件能加快正反应速率的是
A.将容器体积缩小一半使压强增大 B.体积不变充入H2O(g)使压强增大
C.体积不变充入He气使压强增大 D.压强不变充入N2使体积增大
E.体积不变升高温度使压强增大 F.增加C的投入量
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0 kJ/mol;由N2和H2合成1molNH3时可放出46.2kJ的热量。则N-H键的键能是
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接 测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式: Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ/mol Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5 kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________ 。
(4)某反应aA(g)+ b B(g) 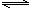 cC(g)+d
D(g),取a molA和b molB置于V L容器中,
cC(g)+d
D(g),取a molA和b molB置于V L容器中,
t min后,测得容器内A的浓度为x mo1/L,这时B的浓度为 mo1/L,
这段时间内反应的平均速率若以物质A的浓度变化来表示应为 。
20. 化学反应N2+3H2 = 2NH3的能量变化如图所示,该反应的热化学方程式是
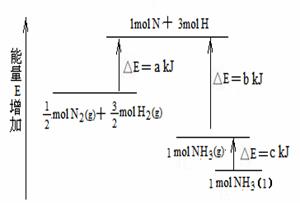 A.N2(g)+3H2(g) = 2NH3(l);
A.N2(g)+3H2(g) = 2NH3(l);
⊿H=2(a-b-c)KJ/mol
B.N2(g)+3H2(g) = 2NH3(g) ;
⊿H = 2(b-a) KJ/mol
C.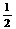 N2(g)+
N2(g)+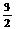 H2(g)
= NH3(l) ;
H2(g)
= NH3(l) ;
⊿H = (b+c-a) KJ/mol
D.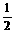 N2(g)+
N2(g)+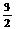 H2(g) =NH3(g) ;
H2(g) =NH3(g) ;
⊿H = (a+b) KJ/mol
第II卷(非选择题 共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com