
题目列表(包括答案和解析)
34.(4分)1.0mol/L的NaOH溶液中,c(OH-)为 mol/L;取此溶液20 mL,向其中加入0.5mol/L的H2S04溶液,当恰好完全中和时,消耗H2SO4溶液的体积为 mL。
33.(7分)某同学为探究碳酸钠的性质,进行了如下实验,请你按要求回答有关问题。
(1)配制100 mL 0.5 mol/L的Na2CO3溶液。该同学应用天平称量Na2CO3固体的质量
为 g。在配制该溶液时,要用到的玻璃仪器有 、 、
和 。
(2)用pH试纸测所配溶液的pH,pH>7,说明Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”);用试管取少量所配溶液,向溶液中滴加几滴酚酞试液,溶液变红,再用酒精灯加热,溶液的颜色变深,说明升高温度,对Na2CO3的水解有 作用。
32.(4分)某实验小组的同学为探究一氧化氮的性质,欲选用下列实验装置来制取一氧化氮。
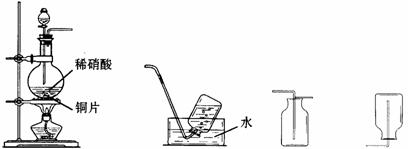
A B C D
请回答下列问题:
(1)用上图中所示的装置制取一氧化氮,选用仪器连接的顺序应是A接 。
(2)稀硝酸具有强氧化性,在常温下就可以和铜发生反应生成一氧化氮气体,写出该反应的化学方程式: 。
在实验过程中,该小组同学采用了微热的方法,目的是 。
(3)实验开始时,该小组同学发现在烧瓶中有红棕色气体产生,请你用化学方程式来表示产生这种现象的原因: 。
31.(8分)下表列出了①〜⑥六种元素在周期表中的位置:
    族
族周期 |
ⅠA |
  |
0 |
|||||
|
1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
① |
② |
③ |
|
|
|
3 |
④ |
|
⑤ |
|
|
⑥ |
|
|
请按要求回答下列问题。
(1)写出下列标号元素的元素符号:① ⑤ ;
(2)元素①形成的最简单的有机物的空间构型为 ;
(3)元素②的最高价氧化物对应水化物的分子式为 ;
(4)元素③所形成的两种氢化物的分子式分别为 和 ;
(5)元素④的氯化物的电子式为 ;
(6)元素⑥的单质在氧气中燃烧的化学方程式是 。
30.(2分)写出下列反应的离子方程式。
(1)碳酸钠溶液与足量盐酸反应
(2)醋酸钠的水解反应
29.(4分)写出下列反应的化学方程式。
(1)实验室加热二氧化锰和浓盐酸的混合物制氯气的反应
(2)在加热的条件下,铜和浓硫酸的反应
(3)实验室加热乙醇和浓硫酸的混合物制乙烯的反应
(4)实验室加热氯化铵和氢氧化钙的混合物制氨气的反应
28.(8分)乙烯是石油化学工业最重要的基础原料,一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一。请根据下图中有机物的相互转化关系,回答有关问题。
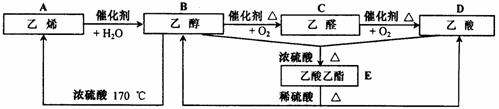
(1)请写出下列有机物官能团的名称。
①-OH ②-CHO ③-COOH
(2)写出下列有机物间转化的反应类型。
①A→B ②B+D→E ③B→C
④B→A ⑤E→B+D
27.(2分)在常温下,物质的量浓度均为0.2mol/L的下述物质的溶液:①HNO3 ②NaOH ③CH3COONa ④KCl ⑤NH4Cl,其中c(H+)最大的是 ,c(OH-)最大的是 。
26.(5分)在3517Cl原子中含有 个质子, 个中子;它的原子结构示意图为 。铁在氯气中燃烧,生成 ,在这个反应中,氯气是 剂(填“氧化’,或“还原”)。
25.要除去下列物质中的杂质,所采用的方法错误的是
A Fe粉中混有的少量Al粉,加足量的NaOH溶液,过滤
B.Cl2中混有的少量HCl,通过盛有足量NaOH溶液的洗气瓶,洗气
C.SiO2中混有的少量Fe2O3,加足量的稀盐酸,过滤
D.NO中混有的少量NO2,通过盛有足量水的洗气瓶,洗气
高中毕业会考化学试卷
第Ⅱ卷(选择题 共50分)
相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Ba 137
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com