
题目列表(包括答案和解析)
8.“中和热”是一个在热化学中的重要概念,“中和热”的定义为:在稀溶
液中,酸跟碱发生中和反应则生成1mol H2O,这时的反应热叫做中和热。
以下关于中和热的叙述正确的是
A.在稀溶液中所有酸和碱反应的中和热数值都相等
B.在稀溶液中HCl和NaOH反应和HNO3和KOH的中和热都相等
C.在稀溶液中1mol酸和1mol碱反应放出的热量都相等
D.将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,产生的热量即为中和热
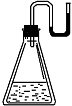
7.有下列物质:① NaOH固体;② 浓硫酸;③ NH4NO3晶体;④ CaO固体。
现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U
形管内的滴有红墨水的水面呈形如右图所示状态,判断加入的物质可能是
A.① ② ③ ④ B.① ② ④ C.② ③ ④ D.① ② ③
6.热化学方程式中化学式前的化学计量数表示
 A.分子个数 B.原子个数 C.物质的质量 D.物质的量
A.分子个数 B.原子个数 C.物质的质量 D.物质的量
5. 1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
A. C + H2O == CO + H2 ; ΔH== +131.3KJ·mol--1
B. C(s)+ H2O(g) == CO(g) + H2(g) ; ΔH== +10.94KJ·mol-1
C. C(s)+ H2O(l) == CO(g) + H2(g) ; ΔH== +131.3KJ·mol--1
D. C(s)+ H2O(g) == CO(g) + H2(g) ; ΔH== +131.3KJ·mol-1
4. 根据以下3个热化学方程式: 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H =―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H =―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H =―Q3 kJ/mol Q1、Q2、Q3三者关系正确的是
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
3. 已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的
A.X的能量一定高于M B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
2.下列说法或表示方法中正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨);ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D.稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
1.下列说法正确的是
A.化学反应都伴随着能量的变化 B.个别化学反应与能量变化无关
C.化学反应都要放出能量 D.放热反应的发生无需任何条件
21. (16分)有如下化学反应:2A(g)+B(g)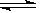 2C(g),△H<0。
2C(g),△H<0。
(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为____________________________;2s时物质B的浓度为____________________;
(2)若把a mol A和b mol B充入一密闭容器中,达到平衡时它们的物质的量满足:
n(A)+n(B)=n(C),则A的转化率为_________________;
(3)若将4 mol A和2 mol B加入体积可变的等压容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为_____________;若再通入少量B气体,体系中A的体积分数_____________(填“增大”、“减小”或“不变”),若要使A的体积分数再达到与原平衡状态相同,可采取的措施有___________________________ 。
(4)右图是一定条件下该反应过程中,体系内各物质浓度的变化情况。反应处于平衡状态的时间是________________,t2时曲线发生变化的原因是_______________________________ ,若在t4时将B的浓度增大0.l mol·L-1,请在下图中画出各物质浓度的变化情况。
20. (10分)在一个固定体积的密闭容器中,保持一定温度进行以下反应:
Br2(g)+ H2(g)
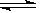 2HBr(g),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①-③的状态,填写表中的空白:
2HBr(g),已知加入1mol H2和2molBr2时,达到平衡后生成amolHBr(见下表已知项)在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①-③的状态,填写表中的空白:
|
已知 编号 |
起始状态的物质的量n/mol |
平衡时HBr的物质的量n/mol |
||
|
H2 |
Br2 |
HBr |
|
|
|
1 |
2 |
0 |
a |
|
|
① |
2 |
4 |
0 |
|
|
② |
|
|
1 |
0.5a |
|
③ |
m |
|
g(g≥2m) |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com