
题目列表(包括答案和解析)
7、分子式为C5H12O的有机物,它的同分异构体中,经氧化可生成醛的有
A.4种 B.3种 C.2种 D.5种
6、羰基碳原子上连有甲基的化合物,与碘在强碱溶液中发生碘仿反应:
 则下列化合物中能发生
则下列化合物中能发生
碘仿反应的是
A. B.
B.
C. D.
D.
5、已知酸性强弱:羧酸>碳酸>酚。下列含溴化合物中的溴原子在适当条件下都能被羟
基取代,所得产物能跟NaHCO3溶液反应的是
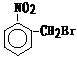
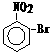
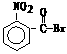
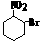
A. B. C. D.
4、某酯的分子式是Cn+3H2n+4O2,它是分子式为CnH2n-2O2的A与有机物B反应生成物,
B的分子式是
A.C3H6O B.C3H6O2 C.C3H8O D.C2H6O
3、分子式为CnH2n+1OH(n¹1)的醇不能发生消去反应,n的最小值是
A. 2 B. 3 C. 4 D. 5
2、下列各组中两物质,互为同系物的是
A.2-甲基-1-丁烯和1,3-丁二烯 B.苯酚和苯甲醇 C.乙酸和乙酸甲酯 D.乙醛和4-甲基戊醛
1、鉴别甲醇和甲酸时不能使用的试剂是
A.银氨溶液 B.钠 C.石蕊试液 D.锌
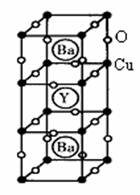
28.(6分)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。
(1)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式:
(2)根据(1)所推出的化合物的组成,计算其中Cu原子的平均化合价(该化合物中各元素的化合价为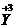 ,
,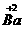 ,
,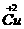 和
和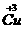 )试计算化合物中这两种价态Cu原子个数比
)试计算化合物中这两种价态Cu原子个数比
27.(16分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
非金属性强弱的判断方法有很多种,请写出另一种判断方法(用化学方程式表示):
_____________________________________________________________
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是_______________ _____ ___ 。
26.(18分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
b |
|
|
|||||||||||||||
|
|
|
|
|
h |
|
j |
|
|
|||||||||
|
a |
c |
f |
|
i |
|
l |
m |
||||||||||
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
(1)上述元素的单质可能是电的良导体的是______(填字母代号)。
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ·mol-1):
|
|
锂 |
X |
Y |
|
第一电离能 |
519 |
502 |
580 |
|
第二电离能 |
7296 |
4570 |
1820 |
|
第三电离能 |
11799 |
6920 |
2750 |
|
第四电离能 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________。
②表中Y可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的电子式是 ________和_________ 。
(3)写出元素e的电子排布式____________________。
(4)以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
(5)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于________区、__________区
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com