
题目列表(包括答案和解析)
12.用热的稀HNO3和足量铁粉反应,反应后溶液中只有Fe(NO3)2,并放出N2O气体4.48L(标准状况),则反应中被氧化的铁粉质量是
A.5.6g B.11.2g C.22.4g D.44.8g
13.下列各组物质的颜色变化,可用勒夏特列原理解释的是
A.新制的氯水在光照条件下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.氯化铁溶液加铁粉振荡后颜色变浅
D.加入催化剂有利于氨的催化氧化
14.两个体积相同的定容的密闭容器A和B,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g。加热到相同温度发生反应:2SO2+O2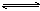 2SO3(g)。对此反应达到平衡时,下列说法不正确的是
A.反应速率A<B B.SO2的转化率A<B
C.平衡时各组分含量A=B D.平衡时容器内压强A<B
15.一定条件下, 在一密闭容器中通入一定量SO2和O2的混合气, 发生如下反应:
2SO2(g) + O2(g)
2SO3(g)。对此反应达到平衡时,下列说法不正确的是
A.反应速率A<B B.SO2的转化率A<B
C.平衡时各组分含量A=B D.平衡时容器内压强A<B
15.一定条件下, 在一密闭容器中通入一定量SO2和O2的混合气, 发生如下反应:
2SO2(g) + O2(g)  2SO3(g)
(正反应为放热反应)。反应达平衡后SO2、O2和SO3的物质的量之比为3∶4∶6, 保持其他条件不变, 降低温度后达到新的平衡时, O2和SO3的物质的量分别为1.1mol和2.0mol, 此时容器内SO2的物质的量应是
A.0.7mol B.0.9mol C.1.1mol D.1.3mol
16.在温度T1时,反应2A(g)
2SO3(g)
(正反应为放热反应)。反应达平衡后SO2、O2和SO3的物质的量之比为3∶4∶6, 保持其他条件不变, 降低温度后达到新的平衡时, O2和SO3的物质的量分别为1.1mol和2.0mol, 此时容器内SO2的物质的量应是
A.0.7mol B.0.9mol C.1.1mol D.1.3mol
16.在温度T1时,反应2A(g)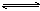 B(g)达平衡后,混合气体的平均分子质量为M1;温度T2时该反应达平衡,混合气体的平均分子质量为M2。当平衡体系由T1上升到T2时,下列说法正确的是
A.若M1>M2,平衡向右移动,(正反应为吸热反应)
B.若M1<M2,平衡向左移动,(正反应为吸热反应)
C.若M1>M2,平衡向左移动,(正反应为放热反应)
D.若M1<M2,平衡向右移动,(正反应为放热反应)
17.可逆反应aA(g)+bB(g)
B(g)达平衡后,混合气体的平均分子质量为M1;温度T2时该反应达平衡,混合气体的平均分子质量为M2。当平衡体系由T1上升到T2时,下列说法正确的是
A.若M1>M2,平衡向右移动,(正反应为吸热反应)
B.若M1<M2,平衡向左移动,(正反应为吸热反应)
C.若M1>M2,平衡向左移动,(正反应为放热反应)
D.若M1<M2,平衡向右移动,(正反应为放热反应)
17.可逆反应aA(g)+bB(g)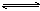 cC(g)+dD(g),根据图象判断,下列叙述正确的是
cC(g)+dD(g),根据图象判断,下列叙述正确的是 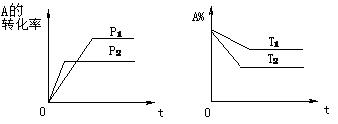
A. p1<p2,a+b<c+d,T1<T2,(正反应为放热反应) B. p1<p2,a+b>c+d,T1>T2,(正反应为吸热反应) C. p1<p2,a+b<c+d,T1>T2,(正反应为吸热反应) D. 以上答案均不对 18.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是①生成物的百分含量一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂 A.①② B.②⑤ C.②③⑤ D.②③④⑤
答题卡
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10.下列哪种说法可以证明反应:N2+3H2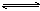 2NH3已达平衡状态
A. 1个N≡N断裂的同时,有2个H-H键形成
B. 1个N≡N断裂的同时,有3个H-H键断裂
C. 1个N≡N断裂的同时,有6个N-H键断裂
D. 1个N≡N断裂的同时,有2个H-H键断裂
11.在100mL某混合酸中,C(HNO3)=0.4mol/L,C(H2SO4)=0.1mol/L,向其中加入1.92g铜粉微热,待充分反应后,溶液中C(Cu2+)为
A. 0.15mol/L B. 0.30mol/L C. 0.225mol/L D. 无法计算
2NH3已达平衡状态
A. 1个N≡N断裂的同时,有2个H-H键形成
B. 1个N≡N断裂的同时,有3个H-H键断裂
C. 1个N≡N断裂的同时,有6个N-H键断裂
D. 1个N≡N断裂的同时,有2个H-H键断裂
11.在100mL某混合酸中,C(HNO3)=0.4mol/L,C(H2SO4)=0.1mol/L,向其中加入1.92g铜粉微热,待充分反应后,溶液中C(Cu2+)为
A. 0.15mol/L B. 0.30mol/L C. 0.225mol/L D. 无法计算
6.反应2A(g)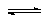 2B(g)+C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减小产物C的浓度 D.降温 7.NO2存在下列反应2NO2
2B(g)+C(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.加压 B.减压 C.减小产物C的浓度 D.降温 7.NO2存在下列反应2NO2 N2O4(正反应为放热反应)。在测定NO2的相对分子量时,下列条件中较为适宜的是
A.温度130℃ 压强3.03×105Pa B.温度25℃ 压强1.01×105Pa
C.温度130℃ 压强5.05×104Pa D.温度0℃ 压强5.05×104P 8.对于可逆反应A(气)+2B(气)
N2O4(正反应为放热反应)。在测定NO2的相对分子量时,下列条件中较为适宜的是
A.温度130℃ 压强3.03×105Pa B.温度25℃ 压强1.01×105Pa
C.温度130℃ 压强5.05×104Pa D.温度0℃ 压强5.05×104P 8.对于可逆反应A(气)+2B(气)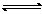 2C(气)(正反应为放热反应) 的平衡体系,下列说法错误的是
A.使用催化剂,υ正、υ逆都改变,变化的倍数相同
B.降低温度,正、逆反应的速率都减小,υ正减小的倍数大于υ逆减小的 倍数
C.增大压强,正、逆反应的速率都增大,υ正增大的倍数大于υ逆增大的倍数
D.升高温度,正、逆反应的速率都增大,υ正增大的倍数小于υ逆增大的倍数
9.在密闭容器中进行下列反应:M(气)+N(气)
2C(气)(正反应为放热反应) 的平衡体系,下列说法错误的是
A.使用催化剂,υ正、υ逆都改变,变化的倍数相同
B.降低温度,正、逆反应的速率都减小,υ正减小的倍数大于υ逆减小的 倍数
C.增大压强,正、逆反应的速率都增大,υ正增大的倍数大于υ逆增大的倍数
D.升高温度,正、逆反应的速率都增大,υ正增大的倍数小于υ逆增大的倍数
9.在密闭容器中进行下列反应:M(气)+N(气)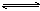 R(气)+2L,此反应符合下面图像,下列叙述正确的是
R(气)+2L,此反应符合下面图像,下列叙述正确的是
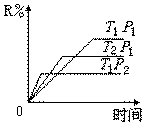 A. 正反应吸热,L是气体
B. 正反应吸热,L是固体
C. 正反应放热,L是气体
D. 正反应放热,L是固体或液体
A. 正反应吸热,L是气体
B. 正反应吸热,L是固体
C. 正反应放热,L是气体
D. 正反应放热,L是固体或液体
1.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达平衡状态的是
A.3υ正(N2)=
υ正(H2) B. υ正(N2)=
υ逆(NH3)
C.2υ正(H2)=
3υ逆(NH3) D. υ正(N2)=
3υ逆(H2)
2.反应A(g)+3B(g)
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达平衡状态的是
A.3υ正(N2)=
υ正(H2) B. υ正(N2)=
υ逆(NH3)
C.2υ正(H2)=
3υ逆(NH3) D. υ正(N2)=
3υ逆(H2)
2.反应A(g)+3B(g) 2C(g)(正反应为放热反应)达平衡后,将气体混合物的温度降低,下列叙述正确的是
A.正反应速率加大,逆反应速率减小,平衡正向移动
B.正反应速率减小,逆反应速率加大,平衡逆向移动
C.正反应速率和逆反应速率都减小,平衡正向移动
D.正反应速率和逆反应速率都减小,平衡逆向移动
3. 对于可逆反应N2+3H2
2C(g)(正反应为放热反应)达平衡后,将气体混合物的温度降低,下列叙述正确的是
A.正反应速率加大,逆反应速率减小,平衡正向移动
B.正反应速率减小,逆反应速率加大,平衡逆向移动
C.正反应速率和逆反应速率都减小,平衡正向移动
D.正反应速率和逆反应速率都减小,平衡逆向移动
3. 对于可逆反应N2+3H2 2NH3,下列各项表示的反应速率最快的是
A. υ(N2)=0.04mol/(L·s) B. υ(H2)=0.02mol/(L·s)
C. υ(H2)=0.6mol/(L·min) D. υ(NH3)=1.2mol/(L·min)
4.在pH=1的溶液中,由于氧化还原反应而不能大量共存的是
A.H+、NO3-、HCO3- B.NH4+、NO3-、SO42-
C.Cl-、SO32-
、SO42- D.Fe2+、SO42-、NO3-
5.在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)
2NH3,下列各项表示的反应速率最快的是
A. υ(N2)=0.04mol/(L·s) B. υ(H2)=0.02mol/(L·s)
C. υ(H2)=0.6mol/(L·min) D. υ(NH3)=1.2mol/(L·min)
4.在pH=1的溶液中,由于氧化还原反应而不能大量共存的是
A.H+、NO3-、HCO3- B.NH4+、NO3-、SO42-
C.Cl-、SO32-
、SO42- D.Fe2+、SO42-、NO3-
5.在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固) 2C(气)(正反应为吸热反应)达到平衡后,改变一个条件(X),下列量(Y)一定符合右图中曲线的是
2C(气)(正反应为吸热反应)达到平衡后,改变一个条件(X),下列量(Y)一定符合右图中曲线的是
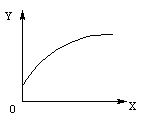
|
|
X |
Y |
|
A |
减小压强 |
A的转化率 |
|
B |
升高温度 |
混合气体平均分子量 |
|
C |
升高温度 |
A的浓度 |
|
D |
增加压强 |
B的转化率 |
26. 0.1mol某有机物与6.72LO2混合点燃充分反应后得到15.68L(体积已折算为标准状况下)CO2、H2O、N2的混合气体,把混合气体先通过浓硫酸再通过碱石灰,气体质量分别减轻7.2g、8.8g。已知该有机物能与盐酸反应也能与氢氧化钠反应,与氢氧化钠溶液混合并加热能产生无色有刺激性气味的气体,此气体能使湿润的红色石蕊试纸变蓝。通过计算确定该有机物的分子式并推断该物质的结构简式。
25. M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,可用于制头盔、防弹背心和刚性前后防护板。下图是有关M5纤维等有机物的转化关系图(部分反应未注明条件):
|
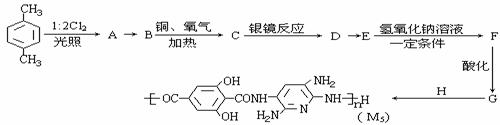
(1)写出下列物质的结构简式:E ;H ;
(2)反应类型:A→B ;B→C ;
(3)生成A的同时可能生成A的同分异构体的结构简式: ;
(4)写出化学反应方程式:C→D ;
E→F ;
(5)1 mol的G与Na2CO3溶液反应,最多消耗Na2CO3 mol;
25.有机物A为茉莉香型香料。
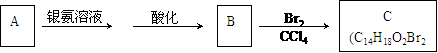
(1)A分子中含氧官能团的的名称是 。
(2)C的分子结构可表示为(其中R和Rノ的代表不同的烃基)
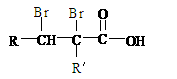
A的化学式是 ,A可以发生的反应是 (填写序号字母)。
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)已知含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′-OH的类别属于 。
(4)A分子结构中只有一个甲基,A的结构简式是 。
(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是
。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的结构有 种。
24. A为只含有C、H、O三种元素的芳香烃衍生物,各物质间的相互转化关系如下图。已知:ROH+HX RX+H2O;E为高分子化合物,分子式为(C9H8O2)n;H分子式为C18H16O6;I中除含有一个苯环外还含有一个六元环,分子式为C9H8O2。
RX+H2O;E为高分子化合物,分子式为(C9H8O2)n;H分子式为C18H16O6;I中除含有一个苯环外还含有一个六元环,分子式为C9H8O2。
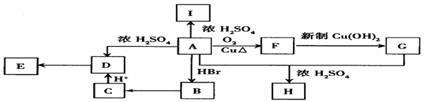
(1)写出A、E、I的结构简式:A_____________;E______________;I_____________。
(2)写出F→G的化学反应方程式:___________________________________________。
(3)B→C的反应条件为____________________________________________________;
A+G→H的反应类型为_________________________________________________。
(4)有机物A的同分异构体只有两个对位取代基,既能与Fe3+发生显色反应,又能发生水解反应,但不能发生银镜反应。则此类A的同分异构体有____________种。
23.有机物在氧气中燃烧,其中的碳氢原子数与消耗氧的量有一定关系,
(1)等质量的醛(CnH2nO)和羧酸(CmH2mO2)分别充分燃烧时n与m为何关系时
消耗氧的量相同________(写出n与m的数学关系)。
(2)等物质量的同碳数的烯烃与饱和一元醇分别充分燃烧时,消耗氧气的量相同。等
物质的量的同氢原子数的_____烃(填烷、烯、炔或苯的同系物)与饱和一元_______(填醇、醛或羧酸或酯)分别燃烧时,消耗氧气的量相同。
22. 下表中列出部分物质的沸点:
|
物 质 |
水 |
乙醇 |
环己烷 |
浓硫酸 |
苯甲酸 |
苯甲酸乙酯 |
乙醚 |
|
沸点/℃ |
100 |
78.4 |
80.7 |
338 |
249 |
213 |
34.6 |
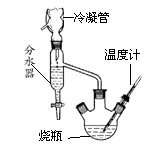 实验室用苯甲酸和乙醇制取苯甲酸乙酯,采用的主要装置如图所示(未画全)。具体的操作过程为在圆底烧瓶中加入苯甲酸、浓硫酸、过量的无水乙醇、沸石。再向烧瓶中加入环己烷(在62℃时和水、乙醇形成共沸物使得乙醇、水、环己烷按一定比例一起蒸发)以
实验室用苯甲酸和乙醇制取苯甲酸乙酯,采用的主要装置如图所示(未画全)。具体的操作过程为在圆底烧瓶中加入苯甲酸、浓硫酸、过量的无水乙醇、沸石。再向烧瓶中加入环己烷(在62℃时和水、乙醇形成共沸物使得乙醇、水、环己烷按一定比例一起蒸发)以
除去多余的乙醇,装上分水器和冷凝管,缓慢加热回流至分水器中
液体不再增加停止加热并冷却。再采取一定的分离提纯措施可得到较纯净的苯甲酸乙酯。
回答下列问题:
⑴ 写出苯甲酸和乙醇制取苯甲酸乙酯的化学方程
式 。
⑵ 实验中加入过量乙醇的目的是 ;反应结时加热的温度不宜超
过 ,原因是 。
⑶ 冷却后的烧瓶中含有的液态物质除苯甲酸甲酯、水外,还有 。
除去这些液态杂质可加入适量的 溶液,并进行蒸馏,收集 ℃左右的馏分得到混有少量水的粗产品。
⑷ 乙醚微溶于水,但它是有机物的良好溶剂。为除去粗产品中的水,在粗产品中加入适量的乙醚进行 、 ,再向醚层中加入适量的无水CaCl2除去醚层中少量的水,醚层过滤入一个干燥的圆底烧瓶,进行 ,先蒸出 ,后蒸出苯甲酸乙酯,得到较纯净的苯甲酸乙酯。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com