
题目列表(包括答案和解析)
3.下列各组离子在指定条件下,一定能大量共存的是( )
A.能使红色石蕊试纸显蓝色的溶液:K+、Fe2+、SO42-、NO3-、Cl-
B.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br-
C.水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl-
D.加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、NO3-
2.下列各式中,表示水解反应的是( )
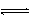
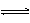 A.H2O + H2O H3O++
OH- B.CO32-+ H2O HCO3-+ OH-
A.H2O + H2O H3O++
OH- B.CO32-+ H2O HCO3-+ OH-
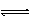
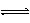 C.NH3 + H2O NH3·H2O
D.HCO3-+ H2O H3O++
CO32-
C.NH3 + H2O NH3·H2O
D.HCO3-+ H2O H3O++
CO32-
1.低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)Nb(铌)等合金元素,下列有关说法正确的是( )
A.Fe位于元素周期表的第四周期,第VIIIB族
B.工业上利用热还原法冶炼金属Fe、Cr、Mn
C.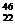 TiO2、
TiO2、 TiO2、
TiO2、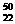 TiO2互为同位素
TiO2互为同位素
D.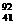 Nb3+原子核内有51个中子,核外有41个电子
Nb3+原子核内有51个中子,核外有41个电子
25.(10分) 将一定质量的铁粉加入到装有100 ml某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 ml(标准状况下)。
①所得溶液中的溶质的化学式是______________;
②原硝酸溶液的物质的量浓度为:________________ mol/L。
(2)向上述固-液混合物中逐滴加入稀硫酸直到刚好不再产生气体为止,该气体遇空气变成红棕色。此时容器中有铁粉n g。
①此时溶液中溶质的化学式是 ____________ ;
②m-n的值为(计算精确到0.1g)____________ g 。
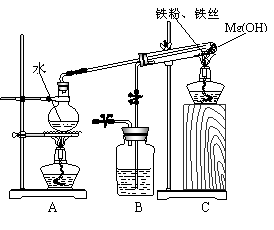
24、(6分)某课外研究小组,利用下列实验装置来完成“铁与
水蒸气的反应”的实验,并检验气体产物。大试管中盛放是:
(1)Mg(OH)2 ,在受热分解后能产生350℃的水蒸
气,使得反应获得足够高的热量;
(2)铁粉和铁丝网,铁丝网的作用是为了加大铁粉与水蒸气
的接触面,并加大传热的效率。该实验能加快反应的速率,
提高实验的成功率。请你回答下列问题:
(1)写出铁与水蒸气反应的化学方程式______________________。
(2)装置B中盛放的是_________,其作用是_____________________________。
(3)在实验进行前必须进行的操作是___________________;
为了检验导管口b处的气体,在检验前必须进行的操作是____________;
(4)实验完毕后的操作是____________________________________________________。
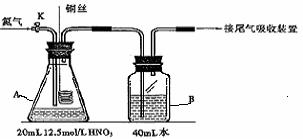
23、(6分)某化学活动小组为探究铜与硝酸反应还原产物主要为NO时硝酸的浓度,设计实验装置如下图所示(连接好仪器并检察气密性后,分别装入相对应的试剂):
Ⅰ.⑴实验开始时先打开活塞K持续通入N2一段时间后,关闭K。将铜丝(足量)下移伸入浓硝酸后,有大量的饿红棕色气体生成,随时间的进行,气体颜色逐渐变浅,当A中充满无色气体时:
①装置A中反应的离子方程式为 ;
②接下来的实验操作是 ;
⑵本实验中装置A的优点是 。
Ⅱ.将B中所得溶液稀释至200ml,用0.2mol/l的NaOH溶液进行中和滴定。实验数据如下(硝酸的挥发分解及溶液体积的变化忽略不计):
|
实验编号 |
待测液体积(ml) |
NaOH溶液体积(ml) |
|
1 |
20.00 |
15.98 |
|
2 |
20.00 |
14.99 |
|
3 |
20.00 |
 15.01 15.01 |
⑴待测液的浓度为 mol/l
⑵硝酸与铜反应主要生成NO时硝酸的浓度不大于 mol/l。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
22.(8分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(2)写出E溶液与过量的B溶液反应的离子方程式。 。
 (3)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为
。
(3)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为
。
21.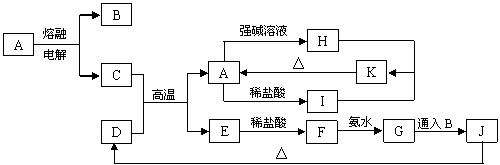 A~K是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已经略去)。已知A是一种高熔点的化合物,D是一种红棕色的固体,H的焰色反应呈黄色。
A~K是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已经略去)。已知A是一种高熔点的化合物,D是一种红棕色的固体,H的焰色反应呈黄色。
请回答下列问题:
(1)A物质的化学式为 。
(2)C与强碱溶液反应的离子方程式为 ;
H和I反应生成K的离子方程式为 ;
(3)G 生成J的化学方程式为_______________________________________________。
(4)D与盐酸反应的离子方程式为 ,常温下所得溶液的pH____(填大于、小于、等于)7,其原因是(用离子方程式表示)______________________。
(5) 不纯的E在潮湿的空气中易发生电化学腐蚀,其负极发生的电极反应式是_____________________;正极发生的电极反应式是______________________________。
20.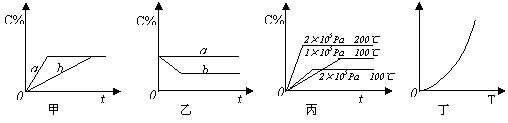 (8分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g)
(8分)如下图,甲、乙、丙分别表示在不同条件下可逆反应:A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
⑴若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则_________曲线表示无催化剂时的情况,原因是_____________________________________________________;
⑵若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He气后的情况,则____________________________曲线表示恒温恒容的情况,原因是________________________________________________________________;
⑶根据丙图可以判断该可逆反应的正反应是_______热反应,计量数x的值_________;
⑷丁图表示在某固定容积的密闭容器中上述可逆反应达到平衡后某物理量随着温度(T)的变化情况,根据你的理解,丁图的纵坐标可以是 ,原因为______________________。
19.(5分)⑴常温下,0.1mol/L的醋酸和0.1mol/L的盐酸各100 mL分别与足量的锌粒反应,产生的气体体积前者比后者______________。
⑵常温下,0.1mol/L的醋酸和pH=1的醋酸各100 mL分别与足量的锌粒反应,产生的气体体积前者比后者_____________。
⑶在25℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同)_________。A.3~5之间 B.5 C.5~7之间 D.7
⑷25℃时,向0.1mol/L醋酸溶液中加入少量的醋酸钠晶体,当晶体溶解后测得溶液的pH将___。
A.增大 B.减小 C.不变 D.无法确定
⑸室温下,向0.1mol/L的H2SO4中加入足量的锌粒,若想减慢制取H2的速率,但又不影响H2的体积,可以向硫酸溶液中加入__________________试剂。
A.硫酸钠溶液 B.醋酸钠晶体 C.少量硫酸铜溶液 D.硝酸钠溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com