
题目列表(包括答案和解析)
5.下列有关化学反应方向的描述中不正确的是
A.一定条件下的可逆反应,反应物的转化率不可能达到100%
B.所有的氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性
C.沉淀转换的实质就是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动
D.△H<0,△S>0的反应一定是自发进行的化学反应
4.如右图所示,a、b是两根石墨棒。下列叙述正确的是
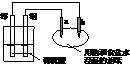 A.a是正极,发生还原反应
A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.稀硫酸中硫酸根离子的物质的量不变
D.往滤纸上滴加酚酞试液,a极附近颜色变红
3.下列电离方程式书写正确的是
A.NaAlO2=Na++AlO2-
B.NaHCO3 Na++HCO3-
Na++HCO3-
C.H2S 2H++S2-
D.CH3COOH=H++CH3COO-
2H++S2-
D.CH3COOH=H++CH3COO-
2.判断下列说法正确的是
A.酸碱盐都是电解质
B.其水溶液能导电的物质都是电解质
C.强电解质溶液的导电性一定比弱电解质溶液的导电性强
D.强电解质都是离子化合物,弱电解质都是共价化合物
1.对于反应2SO2(g)+O2(g) 2SO3(g) △H<0 ,下列措施能增大正反应速率的是
2SO3(g) △H<0 ,下列措施能增大正反应速率的是
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
21.将等物质的量的两种氧化物溶于100mL硫酸,而后逐滴加入1.00mol·L-1的NaOH溶液。当加入的NaOH的体积V1=50mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加。当NaOH的体积V2=650mL时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小。当V3≥750mL时,沉淀量不再改变。
(1)最初加入的50mL NaOH溶液的作用是什么?答: 。
(2)计算所用硫酸的浓度。
(3)试判断两种氧化物各是什么,并计算其物质的量。
20. 右图(上)是还原铁粉与水蒸气反应的实验装置,
右图(上)是还原铁粉与水蒸气反应的实验装置,
实验时,B中灰色的铁粉变为黑色,且生成的黑
色固体物质是一种可溶于稀盐酸的较复杂化合物。
请回答下列问题:
(1)B中发生反应的化学方程式 。
(2)反应前A中投放碎瓷片的目的是
(3)某次实验后,取B中的固体少量,溶于足量
 稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,
稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,
试解释原因 。
(4)右图(下)中虚线部分,可以用右图所示装置代替,
在X口点燃收集到的气体即可检验H2的存在。实
验开始时,打开K1、K2,关闭K3,使反应先进行
一段时间之后,必须进行 操作,方可关闭
K2、打开K3,再收集气体。当收集到半瓶气体时,
停止加热,关闭K1,若要使H2顺利逸出而进行点
燃实验,操作的方法是:
(5)替代装置未像原装置那样使用干燥管,同样顺利完成了实验,原因是
19.用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。称量时,样品可放在 (填编号字母)上称量
A.小烧杯 B.洁净纸片 C.直接放在托盘上
(2)滴定时,用0.2000mol·L一1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视 ;在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1,烧碱样品的纯度是 。
|
滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
|
|
|
滴定前的刻度(mL) |
滴定后的刻度(mL) |
|
第一次 |
10.00 |
0.40 |
20.50 |
|
第二次 |
10.oO |
4.10 |
24.00 |
(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 。
17.水的电离平衡如图所示:
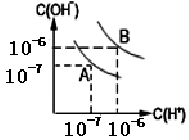
(1)若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点。则此时水的离子积从_____增加到_____。
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃时的恒温,于是混合物溶液的pH=7,则Ba(OH)2与盐酸溶液的体积比______
(3)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com