
题目列表(包括答案和解析)
15.用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是
A.当电池负极消耗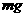 气体时,电解池阴极有
气体时,电解池阴极有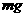 气体生成
气体生成
B.电解池的阳极反应式为:4OH--4e-==2H2O+O2↑
C.电解后,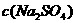 不变,且溶液中有晶体析出
不变,且溶液中有晶体析出
D.电池中 不变;电解池中溶液
不变;电解池中溶液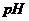 变大
变大
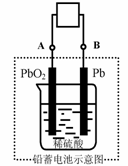
14.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由B经导线流向A
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
13.能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是
A、铜片作原电池的负极,石墨作原电池的正极,氯化钠作电解质溶液
B、铜锌合金在潮湿空气发生电化学腐蚀
C、用铜片作阴、阳电极,电解硫酸钠溶液
 D、用铜片作阴、阳电极,电解硫酸铜溶液
D、用铜片作阴、阳电极,电解硫酸铜溶液
12.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通人少量氯气,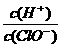 可能增大
可能增大
B.通入少量SO2,溶液的漂白性增强
C.加入固体NaOH,c(ClO-)增大
D.加入少量固体NaCl,水的电离平衡向电离方向移动
11.某透明溶液中,能大量共存的离子组是
A.Na、K+、SO42-、HCO3- B.Ba2+、K+、SO42-、NO3-
C.NH4+、K+、Cl-、OH- D.Fe3+、K+、SCN-、Cl-
10、在恒温下,固定容积的密闭容器中有可逆反应2SO3(g)=2SO2(g)+O2(g) 可用确定该反应已达到平衡状态的是: A.容器内压强不随时间改变 B、SO3 的消耗速率与SO2 的生成率相等 C、正反应生成SO2 的速率与逆反应生成SO3 的速率相等 D、容器内混和气体的密度不随时间改变
9.甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=-71 kJ·mol-1 ②CO(g)+2H2(g)=CH3OH(l) ΔH=-90.5 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 下列说法不能得出的结论是
A.反应②在任何温度下均能自发进行
B.CO(g)+2H2(g)=CH3OH(g) ΔH>-90.5 mol·L-1
C.甲醇的燃烧热ΔH=-764 kJ·mol-1
D.若CO燃烧热ΔH=-282.5 kJ·mol-1,则H2燃烧热ΔH=-286 kJ·mol-1
8.化学工业在经济发展中的作用举足轻重,下列有关工业生产的叙述中,正确的是
A.硫酸生产中常采用高温条件提高SO2的转化率
B.合成氨中采用及时分离氨气提高反应速率
C.电镀铜时,溶液中c(Cu2+)基本保持不变
D.氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气
7.下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g) 2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B.已知C(石墨,s) C(金刚石,s) △H>0,则金刚石比石墨稳定
C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l)△H=-57.4kJ/mol
NaCl(aq)+H2O(l)△H=-57.4kJ/mol
D.己知2C(s)+2O2(g)=2CO2(g) △H1 2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
6.下列微粒对水的电离平衡不产生影响的是
A.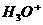 B.
B.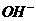 C.
C.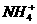 D.
D.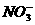
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com