
题目列表(包括答案和解析)
5.“暖宝宝”取暖片的材料中含有铁粉、水、活性炭、硅石、食盐等,它们组成一个原电池,
在反应时释放出热量,铁粉在原电池中充当
A.负极 B.正极 C.阴极 D.阳极
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上 有大量气泡产生,则四种金属的活动性顺序由强到弱为
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
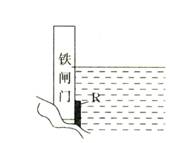
3.为了降低某水库的铁闸门被腐蚀的速率,可以采取如右图所示的方案,其中焊接在铁闸门上的固体材料R可以采用
A.铜 B.钠 C.锌 D.石墨
2. 在钢铁腐蚀过程中,下列五种变化可能发生的是 ①Fe2+转化为Fe3+、②O2被还原、③产生H2、④Fe(OH)3失水形成Fe2O3·xH2O、⑤杂质碳被氧化
在钢铁腐蚀过程中,下列五种变化可能发生的是 ①Fe2+转化为Fe3+、②O2被还原、③产生H2、④Fe(OH)3失水形成Fe2O3·xH2O、⑤杂质碳被氧化
A.①② B.②③④ C.①②③④ D.①②③④⑤
1.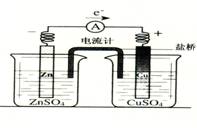 有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
A.铜片上有气泡逸出
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.反应前后铜片质量不改变
(二)某学生用中和滴定实验方法,以标准酸液(盐酸)测定未知浓度的氢氧化钠溶液时,过程如下:(1)取一支碱式滴定管;(2)用蒸馏水洗净;(3)即加入待测的NaOH溶液;(4)记录液面刻度读数;(5)用酸式滴定管精确放出一定量标准酸液;(6)置于未经标准酸液润洗的洁净的锥形瓶中;(7)加入适量蒸馏水;(8)加入酚酞试液两滴;(9)滴定时,边滴边振荡;(10)边注视滴定管内液面的变化;(11)当小心滴到溶液由无色变为粉红色时,即停止滴定;(12)记录液面刻度读数;(13)根据滴定管的两次读数得出NaOH溶液体积为22mL。指出上述实验过程中错误之处(用序号表示) ,其中一定会造成结果偏低的是___________________。
20.(16分)(1)配平方程式:__C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16 mL时反应完全,此时溶液颜色由____变为______。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O和KHC2O4的质量分数分别为多少?(写出计算过程)
21.(11分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/ mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ) 实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ) 实验①和 探究温度对该反应速率的影响; (III) 实验①和 探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
22.(12分)汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)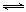 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
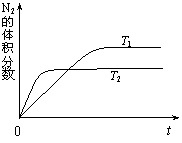 ⑴右图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g)
⑴右图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g)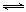 2NO(g)
2NO(g)
为 (填“吸热”或“放热”)反应。
⑵2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数表达式K= ,K的数值= 。
⑶为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图
所示。
写出上述变化中的总化学反应方程式: 。
23. (12分) ⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
。
(12分) ⑴肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是
。
⑵肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶
液。肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
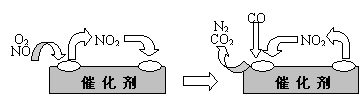
⑶右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,
则肼一空气燃料电池理论上消耗标准状况下的空气 L(
假设空气中氧气体积分数为20%)
⑷传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式: 。
24.(11分)铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的大批量: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ 对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ 对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ 对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ 对;无 |
25.(13分)科学家一直致力研究常温、常压下“人工围氮”的新方法。曾有实验报道:在常温、常压、学照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h):
|
T/K |
303 |
313 |
323 |
353 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(1)=2NH3(g)+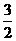 O2(g)
ΔH=+765.2kJ·mol-1
O2(g)
ΔH=+765.2kJ·mol-1
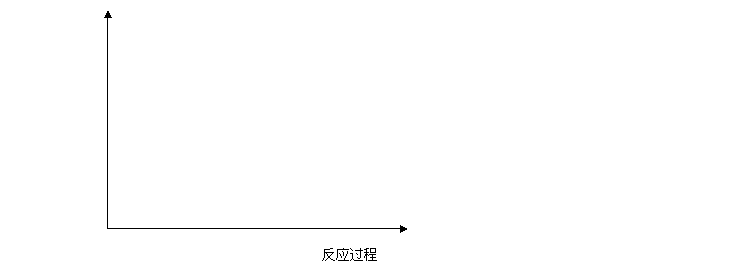
回答下列问题:(1)请以下坐标中画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
|

(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提
 高其反应速率且增大NH3生成量的建议:
。
高其反应速率且增大NH3生成量的建议:
。
(3)工业合成氨的反应为N2(g)+3H2(g) ? 2NH3(g)。设在容积为2.0L的密
闭容器中充入0.60mol N2(g)和1.60
mol H2(g),.反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为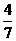 。计算
。计算
①该条件下N2的平衡转化率;(写出计算过程)
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。(写出计算过程)
19、(12分)(一)下列有关化学实验中正确的是
① 用点燃的方法除去CO2中的CO
②浓硫酸、浓硝酸等强氧化性酸保存在带磨口玻璃塞的试剂瓶中
③ 用碱式滴定管量取20.00 mL 0.1000 mol / L KMnO4溶液
④ 配制100mL1.00mol/L的NaCl溶液时,可用托盘天平称取5.85g NaCl固体
⑤ 不慎将浓硫酸沾到皮肤上,应立即用水清洗
⑥ 用瓷坩埚高温熔融Na2CO3
⑦ 物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
18、在恒压密闭容器M(如图Ⅰ)和恒容密闭容器N(如图Ⅱ)中,分别加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:
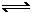 2A(?)+ B(?) xC(g) ΔH<0
2A(?)+ B(?) xC(g) ΔH<0
平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断正确的是
A.x =4
B.若N中气体的密度如图Ⅲ所示,则A、B有一种是气态
C.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D.若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
17.把下列各溶液加水稀释,溶液中每种离子的浓度都不会增大的是
 A.CH3COOH B.NaCl C.NaOH D.FeCl3
A.CH3COOH B.NaCl C.NaOH D.FeCl3
16、已知反应mX(g)+nY(g) qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com