
题目列表(包括答案和解析)
25.(12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
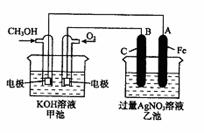 2CH3OH+3O2+4KOH
2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。
甲电池是 装置,乙池是
装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是
,
B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 ,
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
24.(12分)已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下:
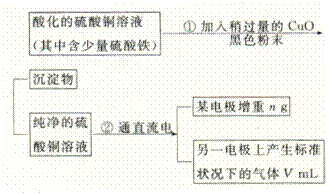
回答下列问题:
(1)加入CuO的作用是
。
(2)步骤②中所用的部分仪器如下图所示,则A、B分别连直流电源的 和 极(填“正”或“负”)。
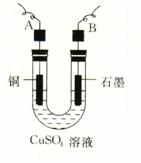 (3)电解开始后,在U形管中可以观察到的现象有:
(3)电解开始后,在U形管中可以观察到的现象有:
。电解的离子方程式为 。
(4)下列实验操作中必要的是 (填写字母)。
(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为 (用带有m、V的计算式表示)。
23. (15分)为省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO4溶液;直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
⑴甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫
酸,观察到的现象是 。甲同学的设计思路
是 。
⑵乙同学接着甲的实验,向烧杯中滴加 溶液,进而观察到的现象是 ,
。乙同学作出锌、铜金属活动性相对强弱所依据的原理是 , 。
⑶丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的
试剂(作为电解液)。反应在调控下随即开始,实验中有关化学反应方程式
为 。获得的实验明显现象是 。
⑷请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌和铜的金属活动性的
相对强弱(简要说明操作和现象) 。
22.(6分)一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu====2Fe2++Cu2+,可以写成:氧化反应 Cu-2e-====Cu2+;还原反应 2Fe3++2e-====2Fe2+(或Fe3++e-====Fe2+)。
(1)根据以上信息将反应3NO2+H2O===2H++2NO3-+NO拆分成两个“半反应式”:氧化反应式 ;还原反应式 。
(2)已知某一反应的“半反应式”为CH4+10OH--8e-====CO32-+7H2O;O2+2H2O+4e-
====4OH-,则总反应式为 。
21.(7分)右图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液呈 性,发生
腐蚀,正极反应式为 。
(3)若试管内液面下降,则原溶液呈 性,发生
腐蚀,正极反应式为 。
20.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性
B放电时电池内部Li向负极移动.
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
19.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成
ClO-,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式是:2Cl--2e-=====Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子
18.用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,且电解后溶液
的pH增大的是
A.KCl B.NaOH C.Na2SO4 D.H2SO4
17.在1L K2SO4和CuSO4的混合溶液中c(SO42-) = 2.0 mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中c(K+)为
A.2.0 mol•L-1 B.1.5 mol•L-1 C.1.0 mol•L-1 D.0.50 mol•L-1
16.为了避免青铜器生成铜绿,以下方法正确的是
A、将青铜器放在银质托盘上 B、将青铜器保存在干燥的环境中
C、将青铜器保存在潮湿的空气中 D、在青铜器的表面覆盖一层防渗的高分子膜
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com