
题目列表(包括答案和解析)
25.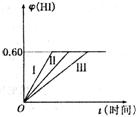 (8分)将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
(8分)将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g);DH<0.并达到平衡。HI的体积分数j(HI)随时间t变化如图曲线(II)所示.
2HI(g);DH<0.并达到平衡。HI的体积分数j(HI)随时间t变化如图曲线(II)所示.
(1)平衡时,I2(g)的物质的量浓度为 mo1/L
(2)若改变反应条件。在甲条件下j(HI)的变化如图曲线(I)所示,在乙条件下j(HI)的变化如图曲线(III)所示.则
甲条件可能是 。乙条件可能是 (填入下列条件的序号)
①恒容条件下,升高温度 ②恒容条件下,降低温度
③恒温条件下.缩小反应容器体积 ④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变。在另一相同的2 L密闭容器中加入amol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0)发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 (用含有a、b、c的代数式表示)
24.(12分)下列反应在210℃达到平衡:
PCl5(g) PCl3(g)+Cl2(g) △H
>0 K=1
①
PCl3(g)+Cl2(g) △H
>0 K=1
①
CO(g)+Cl2(g) COCl2(g) △H <0 K=5×104 ②
COCl2(g) △H <0 K=5×104 ②
COCl2(g) CO(g)+ Cl2(g) △H
>0
③
CO(g)+ Cl2(g) △H
>0
③
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______ ___
_______________________________,K值大小与温度的关系是:温度升高,K值___________________(填一定增大、一定减小、或可能增大也可能减小)。
(2)根据反应①的平衡常数K的表达式,平衡时,下列等式必定成立的是
A.c(PCl5) = c(PCl3)= c(Cl2)=1 B.c(PCl5)= c(PCl3)·c(Cl2)=1 C.c(PCl5)= c(PCl3)·c(Cl2)
反应②和反应③的K值表达式 (填“相同”或“不同”)
(3)降低Cl2浓度,反应③的K值 ____ (填“增大”、“减少”或“不变”)
(4)要使反应①和反应②的K值相等,应采取的措施是
A.反应①、反应②同时升高温度
B.反应①、反应②同时降低温度
C.反应①降低温度,反应②维持210℃
23.(12分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
 (3)若加入B(体积不变),则A的转化率_________。
(3)若加入B(体积不变),则A的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将______ ___。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______ _;而维持容器内压强不变,充入氖气时,混合物颜色____ ___(填“变深”“变浅”或“不变”)。
22.(12分)一定温度下,在一固定体积的容器中,通人一定量的CO和H2O,发生如下反应:CO(g)十H2O(g)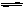 CO2(g)十H2
(g) △H<0
CO2(g)十H2
(g) △H<0
⑴ 在850℃时,CO和H2O浓度变化如下左图,则 0-4min的平均反应速率v(CO)=
_ _ mol·L-1·min-1
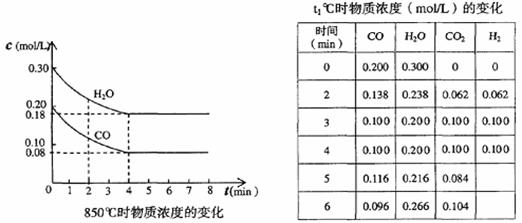
⑵ t1℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。
① 计算t1℃该反应的平衡常数为 ,t1℃ 850℃(填大于、小于或等于)。判断依据是________ _______。
② t1℃时,反应在4min-5min间,平衡 移动(填“向左”、“向右”或“不移动”),可能的原因是________。
a.增加CO的浓度 b.增加H2的浓度 c.加压 d.使用催化剂
⑶ t2℃时,反应CO2(g)十H2 (g)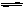 CO(g)十H2O(g)的平衡浓度符合c(CO2)·(H2)=2c(CO)·c(H2O),则t2℃
850℃(填大于、小于或等于)。
CO(g)十H2O(g)的平衡浓度符合c(CO2)·(H2)=2c(CO)·c(H2O),则t2℃
850℃(填大于、小于或等于)。
21.(10分)在水溶液中橙色的Cr2O72-与黄色的CrO42-有平衡关系:Cr2O72- + H2O  2CrO42-+ 2H+,把重铬酸钾溶于水配成稀溶液呈橙色。
2CrO42-+ 2H+,把重铬酸钾溶于水配成稀溶液呈橙色。
(1)向上述溶液中加入KOH溶液,溶液呈 色。
(2)向已加入KOH溶液的溶液中再加入过量稀硫酸,则溶液应是 色,因为 。
(3)向原溶液中加入 硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡
(向左依或向右移),溶液颜色将 。
20.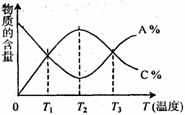 已知可逆反应aA+bB
已知可逆反应aA+bB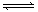 cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
A、该反应在T1、T3温度时达到过化学平衡
B、该反应在T2温度时达到过化学平衡
C、该反应的逆反应是放热反应
D、升高温度,平衡会向正反应方向移动
19.一定温度下,某密闭容器中发生如下反应:A(g)+B(g)
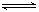 C(g) +D(g)
C(g) +D(g)
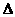 H<0。当反应达到平衡时测得容器中各种物质均为amol。欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是
H<0。当反应达到平衡时测得容器中各种物质均为amol。欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是
A.降低温度 B.恒容时,再通入2amolC和2amolD
C.使容器的体积缩小一半 D.恒容时,再通入amolA和amolB
18.金属钾和金属钠的金属性相近,但K比Na略强,当利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的熔沸点:
K Na KCl NaCl
熔点(℃) 63.6 97.8 770 801
沸点(℃) 774 882.9 1500 1413
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是
A. 低于770℃ B.850℃C. 高于882.9℃ D. 1413-1500℃
17.在密闭容器中反应:aX(g)+bY(g)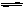 cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.6倍。下列叙述不正确的是
cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.6倍。下列叙述不正确的是
A.a+b>c+d B.平衡向逆反应方向移动 C.Z的体积分数减小 D.X的转化率下降
15.在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
A、前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B、在2 s时,体系内压强为反应前的1.1倍
C、平衡时,体系内含N2O4 0.25 mol
D、平衡时,若往容器内充入氮气,则可提高N2O4的转化率
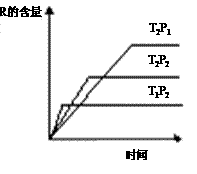 16.在密闭容器中进行下列反应:M (g)+N (g)
16.在密闭容器中进行下列反应:M (g)+N (g)  R
(g)+2 L
R
(g)+2 L
此反应符合下面图像。下列叙述正确的是
A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是液体
D.正反应放热,L是气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com