
题目列表(包括答案和解析)
3.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液
能与原来溶液完全一样的是
A.AgNO3 [Ag2O] B.NaOH [NaOH] C.NaCl [盐酸] D.CuSO4 [Cu(OH)2]
2.在101kPa和25℃时,有反应的热化学方程式:H2(g) + 1/2O2(g) =H2O(g)
△H=-241.8kJ/mol,H2(g) + 1/2O2(g) =H2O(1) △H=-285.8kJ/mol。下列说法中错误的是:
A.H2燃烧生成1molH2O(g)时,放出241.8kJ的热量
B.H2的燃烧热为285.8kJ
C.O2 前面的1/2表示参加反应的O2的物质的量
D.1mol液态水变成水蒸气时吸收44kJ的热量
1.北京举行的2008年奥运会圆满实现了“科技奥运、人文奥运、绿色奥运”的承诺。为了使北京奥运会办成绿色奥运会,下列做法不可取的是:
①开发新能源,减少矿物燃料的燃烧 ②关闭所有的化工企业 ③提倡使用一次性发泡塑料餐具和塑料袋 ④开发、生产无汞电池 ⑤机动车安装尾气净化器
A.①②③ B.③④⑤ C.①④ D.②③
26.(10分)已知2H2(g)+ O2(g)===2H2O(l) ΔH = -571.6 kJ• mol-1
CO(g) + 1/2O2(g) == CO2(g) △H = -283 kJ• mol-1 某H2和CO的混合气体完全燃烧时放出113.74 kJ热量,同时生成3.6 g液态水,求原混合气体中H2和CO的物质的量
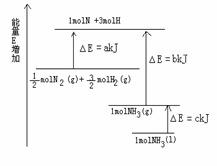
25.(8分)已知化学反应N2+3H2=2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是
能量的过程(填“吸收”或“释放”)。
(2)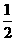 N2(g)+
N2(g)+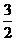 H2(g)=NH3(g
) △H=
;
H2(g)=NH3(g
) △H=
;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
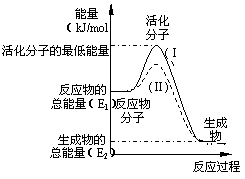
24.(10分)化学反应中,只有极少数能量比平均能量高得
多的反应物分子发生碰撞时才可能发生化学反应,这些分子
称为活化分子,使普通分子变成活化分子所需提供的最低限
度的能量叫活化能,其单位通常用kJ/mol表示。请认真观
察右图,然后回答问题。
⑴图中所示反应是_________(填“吸热”或“放热”)反应,
该反应________(填“需要”或“不需要”)加热,该反应
的ΔH是_______________(用E1、E2表示)。
⑵已知热化学方程式:H2(g)+1/2 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为_________________。
 ⑶对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子数百分数增多,反应速率加快,你认为最可能的原因是________________________。
⑶对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子数百分数增多,反应速率加快,你认为最可能的原因是________________________。
23.(6分)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和
气态水。已知: N2H4 (g) + O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
(1) 肼和二氧化氮反应的热化学方程式为 ;
 (2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟气反应的热化学方程式:
。
(2)有人认为若用氟气代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟气反应的热化学方程式:
。
22.(8分)利用盖斯定律可测某些特别反应的热效应。
(1)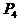 (s,白磷)+
(s,白磷)+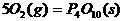
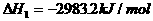
(2)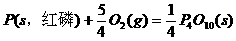
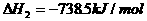
则白磷转化为红磷的热化学方程式____________ _。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”),原因是 。
21.(20分)(1)已知H+(aq)+OH-(aq)==H2O(l) △H=-57.3kJ/mol。
回答有关中和反应的问题。
①用0.1molBa(OH)2配成稀溶液与足量稀硝酸反应,
能放出 kJ热量。
②仪器A的名称 作用是 ;
仪器B的名称 作用是 ;碎泡沫塑料
的作用是 。
③若通过实验测定中和热的△H,其结果常常大于-57.3kJ/mol,其原因可能是
(2)做1次完整的中和热测定实验,温度计需使用 次,某同学为了省去清洗温度计的
麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什
么?
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
20.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ·mol-1 B.CH3OH的燃烧热为676.7 kJ·mol-1
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com