
题目列表(包括答案和解析)
23、(12分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
①“可燃冰”从海底取出后,将融化并放出甲烷气体。试解释其原因:
、 。
②取356g分子式为CH4·9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1780.6kJ的热量,则甲烷燃烧热的热化学方程为 。
(2)设计出能使液化石油气氧化直接产生电流的燃料电池是新世纪最富有挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。
①已知该电池的负极反应为: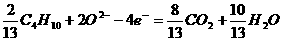 ,则该电池的正极反应为
,电池工作时,固体电解质里的O2-向
极移动。
,则该电池的正极反应为
,电池工作时,固体电解质里的O2-向
极移动。
②液化石油气电池最大的障碍是氧化还原反应不完全而产生的 (填写物质的名称)堵塞电极的气体通道。
(3)能源的紧缺在很大程度上制约着经济的发展,请你提出解决能源紧缺问题的两点建议 。
22.(8分)向某密闭容器中加人 0 . 3 molA 、 0 . 1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为 t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同。已知, t3 ~t4阶段为使用催化剂[已知 t0~ t1阶段 c ( B)未画出] 。
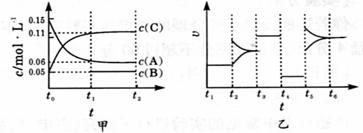
( 1 )若 t1= 15 s ,则t0~ t1阶段以 C 浓度变化表示的反应速率为v( C )= 。
( 2 ) t4 ~t5阶段改变的条件为 , B 的起始物质的量为 。
( 3 ) t5 ~t6阶段容器内 A 的物质的量共减少 0 . 03 mol ,而此过程中容器与外界的热交换总量为 akJ ,写出该反应的热化学方程式 。
21.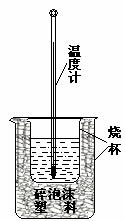 (14分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
(14分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
(1).该图中有两处未画出,它们是 、
.
(2).在操作正确的前提下,提高中和热测定准确性的关键是
____________________ .
(3).做一次完整的中和热测定实验,温度计需使用_______次.
(4).把温度为13℃,浓度为1.0 mol·L-1的酸溶液和1.1mol·L-1的碱溶液各50mL混合[溶液密度均为1g/mL,生成溶液的比热容c=4.184J/(g·℃)],轻轻搅动.测得酸碱混合液的温度变化数据如下:
|
反应物 |
起始温度t1/℃ |
终了温度t2/℃ |
中和热 |
|
HCl+NaOH |
13 |
19.8 |
△H1 |
|
HCl+NH3·H2O |
13 |
19.3 |
△H2 |
①.试计算上述两组实验测出的中和热:△H1=____ ____;△H2=________.
②.两组实验结果差异的原因是________________________________.
20.(15分)某学生进行研究性学习的课题为:用中和滴定法测定某烧碱的浓度。请回答他在主要操作过程中的有关问题:
(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器除天平、药匙外,还有___ __、 、
、 ;
(2)滴定:①盛装0.20mol/L的盐酸标准溶液应该用________式滴定管,②滴定时,锥形瓶中加2--3滴酚酞作为指示剂,滴定过程中,一支手控制滴定管活塞,另一支手_____________,眼睛应注视__________ ______ _,当__________时即为滴定终点;③有关数据纪录如下:
|
滴定序号 |
待测溶液体积(单位:mL) |
所消耗盐酸体积(单位:mL) |
||
|
滴定前读数 |
滴定后读数 |
消耗盐酸体积 |
||
|
1 |
20.00 |
0.50 |
20.60 |
V(平)= ________ |
|
2 |
20.00 |
6.00 |
26.00 |
(3)计算:测得NaOH溶液的浓度为 ____________mol/L,烧碱样品的纯度为 _____。
(4)若该学生测定值偏大了,则该同学引起测定误差的可能原因是____________,
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当指示剂局部变色时,停止滴定
19.(9分)某溶液由Na+ 、Cu2+ 、Fe3+、AlO2- 、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
(1)向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
(2)在(1)所得溶液中加入过量氨水,产生白色沉淀,过滤;
(3)在(2)所得的滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
(4)在(3)所得滤液中加入过量的稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述操作回答下列问题:
(1)原溶液中肯定存在的离子是_______________;
(2)原溶液中可能存在的离子是_______________;
(3)原溶液中肯定不存在的离子是________________。
18.在等温等容条件下有下列气体反应:2A(g)+2B(g) 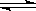 C(g)+3D(g),现分别从两条途径建立平衡:I:A和B的起始浓度均为2mol/L; II:C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是
C(g)+3D(g),现分别从两条途径建立平衡:I:A和B的起始浓度均为2mol/L; II:C和D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是
A.最终达到平衡时,两个途径所得混合物平均相对分子质量相同
B.最终达平衡时,体系内同一气体的体积分数相同
C.最终达平衡时,体系内同一气体的浓度相同
D.最终达平衡时,两个途径的反应速率相同
17.工业上生产苯乙烯是利用乙苯在560℃时的脱氢反应:C8H10 (g) 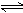 C8H8(g) + H2(g)
C8H8(g) + H2(g)
针对上述反应,有人提出如下观点,其中合理的是
A.在保持体积不变的条件下,充入较多的乙苯,可以提高乙苯的转化率
B.在保持压强不变的条件下,充入不参加反应的气体,可以提高乙苯的转化率
C.在乙苯反应达到平衡过程中,体系的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒容条件优于恒压条件
16.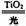 TiO2在光照射下可使水分解:2H2O 2H2↑+O2↑,该过程类似植物的光合作
TiO2在光照射下可使水分解:2H2O 2H2↑+O2↑,该过程类似植物的光合作
用。右图是光照射下TiO2分解水的装置示意图。下列叙述正确的是:
A.该装置可以将光能转化为电能,同时也能转化为化学能
B.铂电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
15.下列事实不能用勒夏特列原理解释的是:
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.合成氨工业上,采用了500℃左右的高温
C.实验室用排饱和食盐水的方法收集氯气
 D.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
D.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
14. 已知热化学反应方程式:
Zn(s)+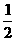 O2(g)
O2(g) ZnO(s) ΔH=-351.5 kJ·mol-1
ZnO(s) ΔH=-351.5 kJ·mol-1
Hg(l)+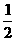 O2(g)
O2(g)  HgO(s) ΔH=-90.84 kJ·mol-1
HgO(s) ΔH=-90.84 kJ·mol-1
则锌汞电池中热化学反应方程式:Zn(s)+HgO(s)  ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为
A. ΔH=+260.7 kJ·mol-1 B. ΔH=-260.7 kJ·mol-1
C. ΔH=-444.2 kJ·mol-1 D. ΔH=+444.2 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com