
题目列表(包括答案和解析)
1.下列叙述中,不正确的是
A.某特定反应的平衡常数仅是温度的函数
B.焓变小于0而熵变大于0的反应肯定是自发的
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
26. (10分)(1)对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,请计算:(1) x的值是多少?(2) L的转化率是多少?(3) M的反应速率v(M)是是多少?
(10分)(1)对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,请计算:(1) x的值是多少?(2) L的转化率是多少?(3) M的反应速率v(M)是是多少?
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。飞 船上宇航员的生活用水由燃料电池提供。
船上宇航员的生活用水由燃料电池提供。
已知这种电池发1度电(3600KJ)时能生成350g水。
25.(12分)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是___________________。
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将______(填“增大”、“减小”、“不变”)。
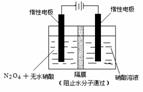 ②下表为反应在T1温度下的部分实验数据:
②下表为反应在T1温度下的部分实验数据:
|
t/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500 s内N2O5的分解速率为________________________________。
③在T2温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2________T1。
(3)如右上图所示装置可用于制备N2O5,则N2O5在电解池的___________区生成,其电极反应式为_________________________________________
24、(12分)在200oC时,将a
molH2(g)和b mol I2(g)充入到体积为VL的密闭容器中,发生反应:H2 (g) + I2 (g)  2 HI
(g)。
2 HI
(g)。
(1)反应刚开始时,由于c (H2)=________,c (I2) =________,而c (HI) =________,
所以化学反应速率_________最大,而_________最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c (H2)=________,c (I2) =________,而c (HI) =________,从而化学反应速率v正__________,
而v逆__________.
(3)当反应进行到v正与v逆_______时,此可逆反应达到了平衡,若保持外界条件不变时,反应混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将__________。
23、 (13分)如图为相互串联的甲乙两个电解池,
(13分)如图为相互串联的甲乙两个电解池,
请回答:
(1)甲池若为用电解原理精炼铜的装置,A极是_________,材料是___________,电极反应为______________,B极是___________,材料是_______________,电极反应为_______________,电解质溶液为______________。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈___________色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下 的体积为_________。
(4)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为_______,pH为______。
22、(10分)已知X和Y是由两种中学常见元素组成的化合物,A、B为气体,G为白色沉淀,F是一种两性化合物,在电解开始时溶液中有白色沉淀产生,但随着电解的进行,白色沉淀逐渐溶解,最后变为C的澄清溶液,X、W、E的焰色反应均为黄色。X~G各物质之间的关系如图(部分产物已略去,除气体间的反应外,其余反应均在溶液中进行)。

⑴X、Y、W的化学式分别为_____________________________________;
⑵写出反应①和电解开始时的离子方程式:
反应①: ;
电解开始时: ;
⑶若要在电解后期得到C的澄清溶液,X和Y必须满足的条件是:____ _ 。
⑷向C的澄清液中加入1mol/L的硫酸,当加至50mL时才开始出现沉淀。假设电解过程中溶液体积变化忽略不计,原X和Y混合液的体积为100ml,原Y溶液的物质的量浓度为amol/L,则原X溶液的物质的量浓度为 mol/L。
21、(8分)限使用下列试剂:酚酞、石蕊、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据:①弱碱在水中存在电离平衡;②弱碱的阳离子会破坏水的电离平衡。这两种平衡的移动均会引起指示剂颜色的变化。由此可分别选用上述试剂,设计两种实验证明NH3•H2O是弱碱,请简述实验方法及现象。
(1)应用①的实验方法及现象:
。(2)应用②的实验方法及现象:
。
20、(10分)(1)现有一个装有CuCl2溶液的烧杯,某一电池,两根石墨电极,一根锌电极,一根铁电极,和导线,你能选用上述仪器和药品设计一个简单实验来判断某电池的正负极吗?
①(4分)请你画出进行该实验的装置图:
②(2分)实验现象及结论是:
(2)(4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
①(2分)写出白色固体转化成黑色固体的化学方程式:
②(2分)白色固体转化成黑色固体的原因是:
19.(12分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?_______________________
(2)为什么不用普通滤纸过滤器过滤?_______________________________
(3)如何保证在70℃-80℃条件下进行滴定操作:_______________
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是___
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O = 2Mn2++10CO2↑+18H2O,问:
①滴定时,高锰酸钾溶液应装在_____ _;
②滴定终点标志是_____________ ;
③KMnO4溶液的物质的量浓度为____ ____ __:
④若滴定前平视,滴定后俯视,则测得的浓度值将_____ ___(填“偏高”或偏低)
18.已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,且其离子浓度的大小顺序为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则原溶质可能为
A.CH3COONa B.CH3COONa、NaOH
C.CH3COOH、CH3COONa D.CH3COOH、NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com